Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi x, y lần lượt là số mol của Fe và Mg.
Theo đề, ta có: \(56x+24y=13,2\) (*)
Ta có: \(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH:
\(3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\left(1\right)\)
\(2Mg+O_2\overset{t^o}{--->}2MgO\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{2}{3}.n_{Fe}=\dfrac{2}{3}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{Mg}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}56x+24y=13,2\\\dfrac{2}{3}x+\dfrac{1}{2}y=0,2\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,15\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Mg}=0,2.24=4,8\left(g\right)\)

Gọi x, y lần lượt là số mol của KMnO4 và KClO3.
Theo đề, ta có: 158x + 122,5y = 56,1 (*)
Ta có: \(n_{O_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
PTHH:
\(2KMnO_4\overset{t^o}{--->}K_2MnO_4+MnO_2+O_2\left(1\right)\)
\(2KClO_3\xrightarrow[MnO_2]{t^o}3KCl+3O_2\left(2\right)\)
Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{KMnO_4}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{3}{2}.n_{KClO_3}=\dfrac{3}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+\dfrac{3}{2}y=0,4\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}158x+122,5y=56,1\\\dfrac{1}{2}x+\dfrac{3}{2}y=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{KMnO_4}=158.0,2=31,6\left(g\right)\)
\(m_{KClO_3}=0,2.122,5=24,5\left(g\right)\)

má ơi tốc độ thân thánh thế em? Em tự làm nhanh hơn anh gõ máy

PTHH: \(4FeS+7O_2\underrightarrow{t^o}2Fe_2O_3+4SO_2\) (1)
\(2ZnS+3O_2\underrightarrow{t^o}2ZnO+2SO_2\) (2)
a) Gọi số mol của FeS là \(a\) \(\Rightarrow n_{Fe_2O_3}=\dfrac{1}{2}a\left(mol\right)\)
Gọi số mol của ZnS là \(b\) \(\Rightarrow n_{ZnO}=b\left(mol\right)\)
Ta lập được hệ phương trình
\(\left\{{}\begin{matrix}88a+97b=54,6\\80a+81b=48,2\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,4\\b=0,2\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,4\cdot88=35,2\left(g\right)\\m_{ZnS}=19,4\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{FeS}=\dfrac{35,2}{54,6}\cdot100\%\approx64,47\text{%}\\\%m_{ZnS}=35,53\%\end{matrix}\right.\)
b+c) Theo các PTHH: \(\left\{{}\begin{matrix}n_{O_2\left(1\right)}=\dfrac{7}{4}n_{FeS}=0,7\left(mol\right)\\n_{O_2\left(2\right)}=\dfrac{3}{2}n_{O_2\left(2\right)}=0,3\left(mol\right)\\n_{SO_2\left(1\right)}=n_{FeS}=0,4\left(mol\right)\\n_{SO_2\left(2\right)}=n_{ZnS}=0,2\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\Sigma n_{O_2}=1\left(mol\right)\\\Sigma n_{SO_2}=0,6\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=1\cdot22,4=22,4\left(l\right)\\V_{SO_2}=0,6\cdot22,4=13,44\left(l\right)\end{matrix}\right.\)

nS = 3,2/32 = 0,1 (mol)
nO2 = 8,96/22,4 = 0,4 (mol)
PTHH: S + O2 -> (t°) SO2
Mol: 0,1 ---> 0,1
nO2 (Al) = 0,4 - 0,1 = 0,3 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,4 <--- 0,3
mAl = 0,4 . 27 = 10,8 (g)
mhh = 10,8 + 3,2 = 14 (g)
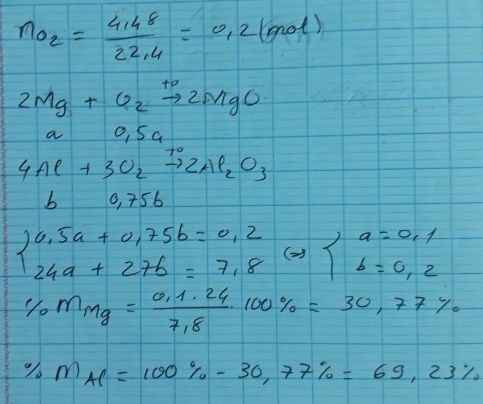


Tương tự:
https://hoc24.vn/cau-hoi/2-de-dot-chay-het-132-gam-hon-hop-gom-bot-fe-va-mg-can-dung-het-448-lit-khio2-dktc-tao-ra-san-pham-la-fe3o4-va-mgo-theo-phan-ungfe-o2-to-fe.3025810936660