
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
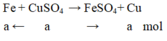
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

a) đúng.
b) sai, đinh sắt đặt trong không khí ẩm mới bị ăn mòn
c) đúng
d) đúng

3. Cho hỗn hợp bột kim loại sắt lẫn tạp chất nhôm vào dung dịch FeCl2 dư
\(2Al+3FeCl_2\rightarrow2AlCl_3+3Fe\)
Lọc bỏ dung dịch, chất rắn sau phản ứng là Fe tinh khiết
4. \(a.Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\\ b.Fe+H_2SO_{4\left(đ,nguội\right)}-/\rightarrow\\ c.2Fe+3Cl_2-^{t^o}\rightarrow2FeCl_3\\ d.Fe+ZnSO_4-/\rightarrow\)

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

Ngâm một đinh sắt trong dung dịch đồng (II) sunfat . Hiện tượng quan sát được là :
A Đinh sắt bị hòa tan một phần , màu của dung dịch đồng (II) sunfat không thay đổi
B Không có hiện tượng nào xảy ra
C Đinh sắt bị hào tan một phần , kim loại đồng bám bên ngoài đinh sắt , màu xanh của dung dịch đồng (II) sunfat nhạt dần
D Đinh sắt không bị hòa tan ,có kim loại đồng bám bên ngoài đinh sắt
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Chúc bạn học tốt

Vì Al đứng trước Cu trong dãy hoạt động hóa học nên có thể đẩy Cu khỏi muối CuSO4
\(PTHH:3CuSO_4+2Al\rightarrow Al_2\left(SO_4\right)_3+3Cu\)
Vậy chọn D