Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu a)
\(m_{ddCuSO_4\left(10\%\right)}=400.1,1=440\left(g\right)\\ m_{CuSO_4\left(dd.10\%\right)}=10\%.440=44\left(g\right)\\ C\%_{ddCuSO_4\left(cuối\right)}=20,8\%\\ \Leftrightarrow\dfrac{m_{CuSO_4}+44}{440+m_{CuSO_4}}.100\%=20,8\%\\ \Leftrightarrow m_{CuSO_4}=60\left(g\right)\)
Vậy: Cần lấy 60 gam CuSO4 hoà tan vào 400 ml dung dịch CuSO4 10% (D=1,1g/ml) để tạo dung dịch C có nồng độ 20,8%
Câu b em xem link này he https://hoc24.vn/cau-hoi/acan-lay-bao-nhieu-g-cuso4-hoa-tan-vao-400ml-dd-cuso4-10d11gml-de-tao-thanh-dd-c-co-nong-do-288-b-khi-ha-nhiet-do-dd-c-xuong-12doc-thi-th.224557369474

1. mdd CuSO4 = 400.1,1 = 440 (g)
mCuSO4=\(440.10\%\)= 44 (g)
Đặt số gam CuSO4 cần hòa tan là m (g)
=> Tổng số gam CuSO4 sau khi hòa tan thành dd thu được = 44 + m (g)
Tổng khối lượng dd CuSO4 thu được sau khi hòa tan = 440 + m (g)
Dung dịch B có nồng độ 20,8%
\(\dfrac{44+m}{440+m}=20,8\%\)
=> m=60 (g)

Gọi số mol CuSO4.5H2O cần lấy là x (mol) => nCuSO4 = x (mol)
Khối lượng CuSO4 2% có trong 400 gam dung dịch là:
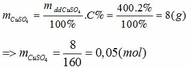
Tổng số mol CuSO4 sau khi hòa tan là: x + 0,05 (mol)
=> thể tích dung dịch sau khi hòa tan:

Từ (1) và (2)
=> (x+ 0,05).1000
=> 1100x + 55 = 160x + 400
=> 850x = 345
=> x ≈0, 406 (mol)
=> mCuSO4.5H2O = 0,406.250 = 101,47 (g)

Ở 12oC có 1335 gam dung dịch CuSO4 bão hòa. Đun nóng dung dịch lên 90oC. Hỏi phải thêm vào dung dịch đó bao nhiêu gam Cu?
Tham khảo tại đây

$n_{CuO} = 0,2(mol)$
\(CuO+H_2SO_4\text{→}CuSO_4+H_2O\)
0,2 0,2 0,2 (mol)
$m_{dd\ H_2SO_4} = \dfrac{0,2.98}{20\%} = 98(gam)$
$m_{dd\ A} =16 + 98 = 114(gam)$
Gọi $n_{CuSO_4.5H_2O} = a(mol)$
Sau khi tách tinh thể :
$n_{CuSO_4} = 0,2 - a(mol)$
$m_{dd} = 114 - 250a(gam)$
Suy ra:
$\dfrac{(0,2 - a).160}{114 - 250a} = \dfrac{17,4}{17,4 + 100}$
$\Rightarrow a = 0,1228(mol)$
$m = 0,1228.250 = 30,7(gam)$

Câu 4:
mdd = 0.35*106+0.35*10*18+234.9=335g
=> C% dd Na2CO3 = 0.35*106*100/335 = 11.07%
Vdd = 0.35*10*18+234.9=297.9ml (coi như Na2CO3 có thể tích ko đáng kể)
=> CmddNa2CO3 = 0.35/0.2979=1.17M
=> D = m/V = 335/297.9 = 1.12 g/ml
Câu 3:
:trong 560g d^2CuSO4 16%
\(mct=\dfrac{16.560}{100}=89,6g\)
Đặt mCuSO4.5H2O = x(g)
1mol(hay 250g) CuSO4.5H2O chứa 160g CuSO4
Vậy x(g) // chứa = (g)
mdd CuSO4 8% có trong dd CuSO4 16% là ( 560 - x ). g
mct CuSO4( có trong dd CuSO4 8%) là = \(\dfrac{8\left(560-x\right)}{100}=\dfrac{2\left(560-x\right)}{25}\left(g\right)\)
Ta có phương trình: \(\dfrac{560-x)2}{25}+\dfrac{16x}{25}=89,6\)
Giải phương trình được: x = 80.
Vậy cần lấy 80g tinh thể CuSO4.5H2O và 480g dd CuSO4 8% để pha chế thành 560g dd CuSO4 16%.
Ta có phương trình:
a) mdd CuSO4 = Vdd CuSO4 . dCuSO4 = 400.1,1 = 440 (g)
mCuSO4 = mdd CuSO4 . C% : 100% = 440 . 10% : 100% = 44 (g)
Đặt số gam CuSO4 cần hòa tan là m (g)
=> Tổng số gam CuSO4 sau khi hòa tan thành dd thu được = 44 + m (g)
Tổng khối lượng dd CuSO4 thu được sau khi hòa tan = 440 + m (g)
dd C thu được có C% CuSO4 = 20%
⇒mCuSO4sau\mddCuSO4sau.100%=20%
⇒44+m\440+m.100%=20%
⇒4400+100m=8800+20m
⇒80m=4400
⇒m=55(g)
2)
Xét ở nhiệt độ thường dd C có
mCuSO4 = 44 + m
= 44 + 55 = 99 (g)
m dd CuSO4 = 440 + m
= 440 + 55 = 495 (g)
=> mH2O có trong dd C = 495 - 99 = 396 (g)
ở 12 độ C có:
nCuSO4.5H2O = mCuSO4.5H2O : MCuSO4.5H2O = 60 : 250 = 0,24 (mol)
có: nCuSO4 trong tinh thể=nCuSO4.5H2O=0,24 (mol) => mCuSO4 trong tinh thể=0,24.160=38,4 (g)
=> m CuSO4 còn lại trong dd = mCuSO4 trong C - mCuSO4 trong tinh thể
= 99 - 38,4 = 60,6 (g)
có: nH2O trong tinh thể = 5 nCuSO4.5H2O = 5.0,24 = 1,2 (mol)
=> mH2O trong tinh thể = 1,2.18 = 21,6 (g)
=> mH2O còn lại trong dd = mH2O trong dd C - mH2O trong tinh thể
= 396 - 21,6
= 374,4 (g)
Cứ 60,6 gam CuSO4 tan bão hòa trong 374,4 gam H2O
Vậy x = ? gam CuSO4 tan bão hòa trong 100 gam H2O
⇒x=60,6×100\374,4=16,19(g)
Vậy độ tan của CuSO4 ở 12 độ C là 16,19 gam
#tk
vl bạn làm bài nào đấy :)