Câu 1.1: Khử hoàn toàn 4,06gam một oxit kim loại bằng CO ở nhiệt độ cao thành kim loại.Dẫn toàn bộ khí sinh ra vào bình đựng dd Ca(OH)2 dư thì tạo thành 7gam kết tủa.Nếu lấy lượng kim loại sinh ra hòa tan hết vào dd HCl dư thì thu đc 1,176 lít khí H2(đktc).Xác định công thức của oxit kim loại.
Câu 1.2: Hòa tan hoàn toàn m gam hỗn hợp gồm Al,Al2O3và Al(OH)3 bằng một lượng vừa đủ dd H2SO4 20%.Sau khi phản ứng kết thúc,thu đc 273,75gam dd Al2(SO4)3 21,863% và 5,04 lít H2(đktc).Viết các phương trình hóa học xảy ra và tính giá trị m

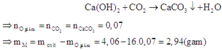
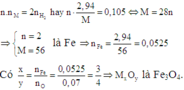
Câu 1.1 :
$Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O$
n CO2 = n CaCO3 = 7/100 = 0,07(mol)
$CO + O_{oxit} \to CO_2$
n O(oxit) = n CO2 = 0,07(mol)
=> m kim loại = 4,06 -0,07.16 = 2,94(gam)
Gọi kim loại là R ; n H2 = 1,176/22,4 = 0,0525(mol)
$2R + 2n HCl \to 2RCl_n + nH_2$
n R = 2/n n H2 = 0,105/n(mol)
=> R.0,105/n = 2,94
=> R = 28n
Với n = 2 thì R = 56(Fe)
n Fe = 2,94/56 = 0,0525(mol)
Ta có :
n Fe / n O = 0,0525 / 0,07 = 3/4
Vậy CT oxit là Fe3O4
Ta có :
n Al2(SO4)3 = 273,75.21,863%/342 = 0,175(mol)
Bảo toàn nguyên tố S :
n H2SO4 = 3n Al2(SO4)3 = 0,525(mol)
n H2 = 5,04/22,4 = 0,225(mol)
Bảo toàn nguyên tố H :
n H2SO4 = n H2 + n H2O
=> n H2O = 0,525 - 0,225 = 0,3(mol)
Bảo toàn khối lượng :
m + 0,525.98 = 273,75.21,863% + 0,225.2 + 0,3.18
=> m =14,25(gam)