Cho hỗn hợp B gồm C2H4 và C2H2.Lấy 2,96g hỗn hợp B đem đốt cháy hoàn toàn thu đc m1 gam CO2 và m2 gam H2O .Lấy 1,232 lít B (đktc) cho phản ứng với luongj dư nước brom thấy có 13,6g brom tham gia phản ứng(phản ứng xảy ra hoàn toàn)
a)Vt các phương trình phản ứng xảy ra
b)tính m1 và m2

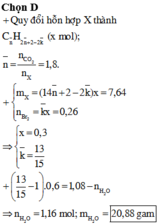

a)
$C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O$
$2C_2H_2 + 5O_2 \xrightarrow{t^o} 4CO_2 + 2H_2O$
$C_2H_4 + Br_2 \to C_2H_4Br_2$
$C_2H_2 + 2Br_2 \to C_2H_2Br_4$
b)
n C2H4 = a(mol) ; n C2H2 = b(mol)
=> 28a + 26b = 2,96(1)
Mặt khác :
n B = 1,232/22,4 = 0,055(mol)
n Br2 = 13,6/160 = 0,085(mol)
Suy ra :
(a + b) / ( a + 2b) = 0,055/0,085 (2)
Từ (1)(2) suy ra a = 0,05 ; b = 0,06
Theo PTHH :
n CO2 = 2a + 2b = 0,22(mol) => m1 = 0,22.44 = 9,68(gam)
n CO2 = 2a + b = 0,16(mol) => m2 = 0,16.18 = 2,88(gam)
cái cuối là nH20 mới đúng chứ