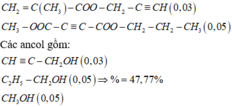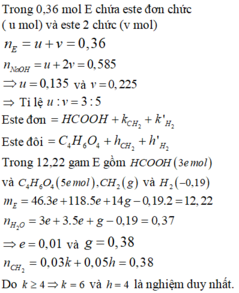Hỗn hợp X gồm KOH,NaOH,Mg(OH)2 trong đó số mol của KOH=số mol của NaOH . Hòa tan X bằng dd H2SO4 9,8% thu được dd Y chỉ chứa muối sunfat trung hòa trong đó nồng độ% của Na2SO4 là 2,646%. Tính nồng độ mol % các muối còn lại trong dd Y
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
0,05 mol NO2 đã nhận 0,05 mol e
⇒ số mol điện tích (+) tạo ra là 0,05 mol
⇒ Số mol NO3- là 0,05 mol
⇒ m = mmuối – mNO3- = 7,06 - 0,05.62 = 3,96g

Đáp án B
Do H2SO4 chưa biết nồng độ nên xét 2 trường hợp:
TH1: H2SO4 loãng:
Fe + H2SO4 → FeSO4 + H2
x y
⇒Loại vì x = y
TH2: H2SO4 đặc nóng
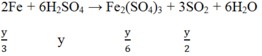
Ta có:
![]()
Do Fe dư nên tiếp tục xảy ra phản ứng:
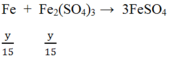
![]()
Vậy Fe hết
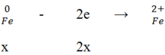
S + 2e → SO2
y y/2
Áp dụng định luật bảo toàn electron ta có: 2x = y

Đáp án là A
Trong 0,36 mol E chứa este đơn chức ( u mol) và este 2 chức (v mol)
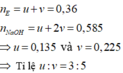
Este đơn = HCOOH + k C H 2 + k ' H 2
Este đôi = C 4 H 6 O 4 + h C H 2 + h ' H 2
Trong 12,22 gam E gồm HCOOH (3e mol) và C 4 H 6 O 4 (5e mol), C H 2 ( g ) và H 2 ( - 0 , 19 )
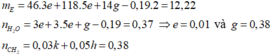
Do k ≥ 4 ⇒ k = 6 v à h = 4 là nghiệm duy nhất.
n H 2 = - 0 , 03 k ' - 0 , 05 h ' = - 0 , 19
Hai chất cùng liên kết pi nên k'-1= h' => k'=3 và h'=2
Do hai muối cùng C, các ancol bậc 1 gồm 1 ancol không no và hai ancol no
=> Các este gồm: