Hòa tan 6 gam hỗn hợp Al, Cu và Fe vào dung dịch HCl thu được 3,024 lít khí H2 ở đktc và còn lại 1,86 gam chất không tan. Xác định thành phần % theo khối lượng của các kim loại trong hỗn hợp ( Biết Cu không tan trong axit )
GIÚP MÌNH VỚI, MÌNH CẦN GẤP !!!!!

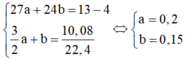
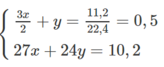




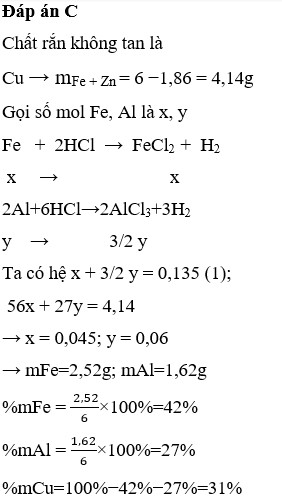
Ta có: mCu = 1,86 (g)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Có: mAl + mFe = 6 - 1,86 = 4,14 (g)
Giả sử: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 56y = 4,14 (1)
Ta có: \(n_{H_2}=\dfrac{3,024}{22,4}=0,135\left(mol\right)\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y\left(mol\right)\)
\(\Rightarrow\dfrac{3}{2}x+y=0,135\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,06\left(mol\right)\\y=0,045\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Cu}=\dfrac{1,86}{6}.100\%=31\%\\\%m_{Al}=\dfrac{0,06.27}{6}.100\%=27\%\\\%m_{Fe}=42\text{%}\end{matrix}\right.\)
Bạn tham khảo nhé!
Chất rắn không tan sau phản ứng là Cu
=> m Cu = 1,86(gam)
Gọi n Al =a (mol) ; n Fe = b(mol) => 27a + 56b = 6 -1,86 = 4,14(1)
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
n H2 = 1,5a + b = 3,024/22,4 = 0,135(2)
Từ (1)(2) suy ra a = 0,06 ; b = 0,045
Vậy :
%m Cu = 1,86/6 .100% = 31%
%m Al = 0,06.27/6 .100% = 27%
%m Fe = 100% -31% -27% = 42%