Hòa tan hết hỗn hợp A gồm 3,84 gam Mg và 2,16 gam Al vào dung dịch H2SO4 đặc, nóng, dư thu được 1,568 lít khí X (sản phẩm khử duy nhất) ở đktc. Gọi tên X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
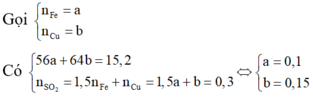
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

Đáp án A
Đặt nFeO = 2x mol; n F e 3 O 4 = x mol
→nFe = 2x+3x = 5x mol; nO = 2x+ 4x = 6x mol
20 gam hỗn hợp rắn Y có chứa Fe và O
→mO (trong Y) = mY - mFe = 20-5x.56 gam
→mO (đã phản ứng) = mO (X) - mO (Y) = 6x.16- (20-5x.56) = 376x-20 (gam)
→nO (đã phản ứng)= 376 x - 20 16 ( m o l ) = nCO pứ
CO+ m gam X→ 20 gam Y + H2SO4 đặc nóng dư→ Fe2(SO4)3+ SO2
Ta có: n S O 2 = 5,6/22,4 = 0,25 mol
- Quá trình cho e:
C+2 → C+4+ 2e
Fe→ Fe3++ 3e
5x → 15x mol
- Quá trình nhận e:
S+6+ 2e→ SO2
0,5← 0,25 mol
O + 2e →O-2
Bản chất phản ứng khử oxit sắt: CO + O(oxit) → CO2
Áp dụng định luật bảo toàn e: ne cho = ne nhận
→ 2 . 376 x - 20 16 +15x = 0,5+ 6x.2→ x = 0,06 mol
→m = 72.2x+ 232x = 22,56 gam

Quy đổi X thành hai nguyên tố R (x mol) và O (y mol).
nSO2 = 8,96/22,4 = 0,4 (mol)
Quá trình khử:
S+6 + 2e ---> S+4
0,8 <-- 0,4
O0 + 2e ----> O-2
y -> 2y
Quá trình oxi hóa:
R0 ----> R+3 + 3e
x --------------> 3x
Áp dụng định luật bảo toàn e:
0,8 + 2y = 3x (1)
Ta lại có:
mO2/mhh . 100% = 22,222%
<=> mO2/46,8 = 0,22222
=> mO2 \(\approx\) 10,4 (g)
=> y = nO2 = 10,4/16 = 0,65 (mol)
Thế y vào (1) ta được x = 0,7 (mol)
mR = 46,8 - 10,4 = 36,4 (g)
=> MR = 36,4/0,7 = 52 (g/mol)
=> R là Cr.
Theo gt ta có: $n_{Mg}=0,16(mol);n_{Al}=0,08(mol);n_{khi}=0,07(mol)$
Bảo toàn e ta có: $n_{e}=0,56(mol)$
$\Rightarrow e=8$
Vậy chất khử X là $H_2S$
n Mg = 3,84/24 = 0,16(mol)
n Al = 2,16/27 = 0,08(mol)
n X = 1,568/22,4 = 0,07(mol)
Gọi n là số e trao đổi của X khi pư
Bảo toàn e, ta có :
2n Mg + 3n Al = n . nX
<=> 0,16.2 + 0,08.3 = 0,07n
<=> n = 8
Vậy X là H2S(hidro sunfua)