Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=\dfrac{150.1,28.25\%}{40}=1,2\left(mol\right)\)
Dung dịch kiềm hấp thụ tối đa CO2 :
\(NaOH+CO_2\rightarrow NaHCO_3\)
=> \(n_{CO_2}=n_{NaOH}=1,2\left(mol\right)\)
=> \(V_{CO_2}=1,2.22,4=26,88\left(l\right)\)

Kí hiệu CO 2 và SO 2 là YO 2 => Σn YO 2 cần dùng = 0,25 mol
Chất tan sinh ra khi dung dịch NaOH hấp thụ tối đa YO 2 sẽ là NaHYO 3
YO 2 + NaOH → NaHYO 3
a = 0,25/0,5 = 0,5 (mol/l)

mddNaOH=V.D=150.1,18=177(g)
\(\Rightarrow\)mNaOH=\(\dfrac{C\%.m_{dd}}{100\%}=\dfrac{25.177}{100\%}=44,25\left(g\right)\)
nNaOH=\(\dfrac{m}{M}=\dfrac{44,25}{40}=1,1065\left(mol\right)\)
pthh: 2NaOH + CO2 \(\rightarrow\)Na2CO3 + H2O
1,1065 .... ....0,553125 (mol)
\(\Rightarrow\)VCO2=n.22,4=0,553125.22,4=12,39(l)
Vậy 150ml dd kiềm hấp thu được tối đa 12,39(l) CO2(đktc)
Để hấp thụ tối đa lượng CO2 thì sản phẩm tạo thành là muối axit NaHCO3.
\(n_{NaOH}=\dfrac{150.1,18.25\%}{23+17}\approx1,11mol\)
PTHH: CO2 + NaOH → NaHCO3
\(\Rightarrow n_{CO2}=n_{NaOH}=1,11mol\\ \Rightarrow V_{CO2}=24,864lit\)

khi cho CO2 tác dụng với dd NaOH thì sau pư chỉ có thể tạo ra hai muối là Na2CO3 và NaHCO3 thì Na2CO3 và NaHCO3 không thể pư được với CO2 nên sẽ có dư dd NaOH ,khi cho dd NaOH tác dụng với CO2 có pthh:
CO2+2NaOH\(\rightarrow\)Na2CO3+H2O(1)
Theo đề bài và pthh(1) ta có:nNaOH=1\(\times\)0,4=0,4(mol)
dd X có Na2CO3 và NaOH (dư)
sau đó thì dd X có khả năng hấp thụ 2,24l CO2 nên nNaOH(dư)=2nCO2(trong 2,24l)=2,24:22,4=2\(\times\)0,1=0,2 (mol)
nCO2(pư)=0,4-0,2=0,2(mol)
vậy V CO2=0,2\(\times\)22,4=4,48(l)

Chọn đáp án C
Có n C O 2 = 5 , 6 22 , 4 = 0 , 25 m o l
n H C O 3 - = n K O H = 0 , 1 m o l
⇒ n C O 3 2 - = 0 , 25 - 0 , 1 = 0 , 15 m o l
⇒ n N a O H = 2 n C O 3 2 - + n H C O 3 - = 0 , 4 m o l
⇒ a = 0 , 4 0 , 2 = 2
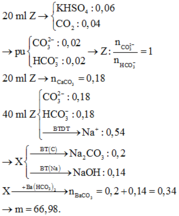
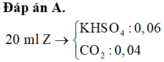
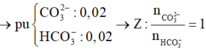

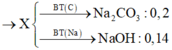
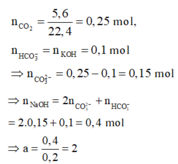
kich mk nhé
không đc , bạn nào trả lời đúng thì mình tk