Để sản xuất 5m3 dung dịch H2SO4 98% ( d=1,84g/ml), hiệu suất của cả quá trình là 80% thì khối lượng quặng pirit sắt ( chứa 80% FeS2) cần dùng là:
A.8425 kg B.8625 kg C.6900 kg D.5520 kg
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
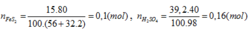
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

ôi t làm nhầm....kq là
3,8 tấn ( cân bằng thêm 2 vào h2so4 là okok)
FeS2 ==> H2SO4
120g 98g
2,85( vì 5% tạp chất) 2,3275 (tấn)
vì H=80% ====> m H2SO4=1,3965( tấn). nhưng có C% H2SO4= 98%
VẬY mdd H2S04 là 1,425 tấn

m FeS2 = 0,9 tấn = 900 kg
4 FeS2 + 11 O2 -> 2 Fe2O3 + 8 SO2
2 SO2 + O2 -> 2 SO3
SO3 + H2O -> H2SO4
ta có 120 g FeS2 điều chế được 196 g H2SO4
=> 900 kg FeS2 điều chế được 1470 kg H2SO4
do H = 80% (Nếu là hiệu suất phản ứng ta phải tính hiệu suất điều chế = 80%. 80% . 80% = 51,2 %)
nên thực thế chỉ thu được 1470 . 80% = 1176 (kg) H2SO4
m dd H2SO4 = 1176 : 98% = 1200 (kg) = 1 200000 g
V dd H2SO4 = 1 200 000 : 1,84 = 652173 ml = 652 l
bạn ơi cho mình hỏi ta có 120 g FeS2 điều chế được 196 g H2SO4 ở đâu ra vậy
5 m3 = 5 000 000(ml)
n H2SO4 = 5 000 000.1,84.98%/98 = 92 000(mol) = 92(kmol)
Bảo toàn nguyên tố với S : n FeS2 = 1/2 n H2SO4 .80% = 36,8(kmol)
=> m pirit sắt = m FeS2/80% = 36,8.120/80% = 5520(kg)
Đáp án D