Cho một lượng kim loại sắt tác dụng với 100ml dung dịch h2so4 loãng sinh ra 5,6l khí h2 ở dktc a) hãy viết phương trình hóa học xảy ra b) tính khối lượng sắt đã tham gia phản ứng c) tính nồng độ mol của dung dịch h2so4 đã dùng CẦN GẤP LẮM RỒI MỌI NGƯỜI GIÚP ĐỠ CHO EM VỚI

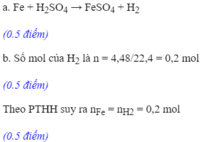

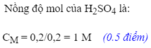
\(n_{H_2}=\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(0.25....0.25.......................0.25\)
\(m_{Fe}=0.25\cdot56=14\left(g\right)\)
\(C_{M_{H_2SO_4}}=\dfrac{0.25}{0.1}=2.5\left(M\right)\)
a. PTHH: Fe+H2SO4-->FeSO4+H2
b. Có nH2=\(\dfrac{5.6}{22.4}=0.25\left(mol\right)\)
Theo pthh trên, nFe=nH2=0.25mol
=> mFe=0.25*56=14g
c. Theo pthh trên, nH2=nH2SO4=0.25mol
Đổi 100ml=0.1l
=> \(C_M=\dfrac{0.25}{0.1}=2.5M\)