Lấy 19,3 g hh bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dd chứa 0,2 mol Fe2(SO4)3 . Sau khi các PƯ xảy ra hoàn toàn, thu được m (g) kim loại. Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g

\(3Zn+Fe_2\left(SO_4\right)_3\rightarrow3ZnSO_4+2Fe\)
x -------------0,2---------------------------\(\dfrac{2x}{3}\) (mol)
\(3Cu+Fe_2\left(SO_4\right)_3\rightarrow3CuSO_4+2Fe\)
2x -----------0,2------------------------------\(\dfrac{4x}{3}\) (mol)
Gọi x(mol) là số mol của Zn và Fe
Theo đề bài ta có:
\(m_{Zn}+m_{Cu}=m_{hh}\)
⇔ 65 . x + 64 . 2x = 19,3
⇔ x = 0,1(mol)
⇒ \(\left\{{}\begin{matrix}n_{Zn}=0,1\left(mol\right)\\n_{Cu}=0,2\left(mol\right)\end{matrix}\right.\)
\(n_{Fe}=\dfrac{2x}{3}+\dfrac{4x}{3}=\dfrac{2.0,1}{3}+\dfrac{4.0,2}{3}=0,33\left(mol\right)\)
\(m_{Fe}=n.M=0,33.56=18,48\left(g\right)\)
\(m_{Fe_2\left(SO_4\right)_3}=n.M=0,2.400=80\left(g\right)\)
Ta có: \(m_{hh}+m_{Fe_3\left(SO_4\right)_3}=m_{kl}+m_{Fe}\)
⇔ \(m_{kl}\) = 19,3 + 80 - 18,48 = 80,82(g)

Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = \(\dfrac{0,1.2}{1}\) = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= \(\dfrac{0,2.1}{2}=0,1\left(mol\right)\)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g

a) \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_M=a\left(mol\right)\\n_{Al}=2a\left(mol\right)\end{matrix}\right.\)
=> a.MM + 54a = 15,6 (1)
\(n_{Cl_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
M0 - 2e --> M+2
a--->2a
Al0 - 3e --> Al+3
2a-->6a
Cl20 + 2e --> 2Cl-1
0,6-->1,2
2H+1 + 2e --> H20
0,4<--0,2
Bảo toàn e: 2a + 6a = 1,6
=> a = 0,2
Thay vào (1) => MM = 24 (g/mol)
=> M là Mg
b) Xét \(m_{Mg}+m_{Al}=0,1.24+0,2.27=7,8\left(g\right)\)
=> Không có khí thoát ra
=> pư tạo ra sản phẩm khử là NH4NO3
PTHH: 4Mg + 10HNO3 --> 4Mg(NO3)2 + NH4NO3 + 3H2O
0,1---->0,25
8Al + 30HNO3 --> 8Al(NO3)3 + 3NH4NO3 + 9H2O
0,2--->0,75
=> nHNO3 = 0,25 + 0,75 = 1 (mol)

Do ở TN2, khi tăng lượng HCl, khối lượng rắn tăng thêm
=> Trong TN1, HCl hết, kim loại dư
- Xét TN1
Theo ĐLBTKL: mA + mHCl = mrắn sau pư + mH2
=> 18,6 + 36,5.0,5a = 34,575 + 2.0,25a
=> a = 0,9
- Xét TN2:
Giả sử HCl hết
Theo ĐLBTKL: 18,6 + 0,9.36,5 = 39,9 + 0,45.2
=> 51,45 = 40,8 (vô lí)
=> HCl dư, kim loại hết
Gọi số mol Zn, Fe là a, b
=> 65a + 56b = 18,6
PTHH: Zn + 2HCl --> ZnCl2 + H2
a--------------->a
Fe + 2HCl --> FeCl2 + H2
b---------------->b
=> 136a + 127b = 39,9
=> a = 0,2 ; b = 0,1
=> \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)
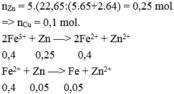
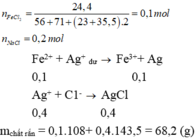

Đặt nZn = x (mol) và nCu = 2x (mol)
(Vì hỗn hợp bột gồm Zn và Cu có tỉ lệ về số mol là 1:2)
⇒ mhỗn hợp = mZn + mCu
= 65x + 64 × 2x) = 19,3 g
⇒ x = 0,1 mol
Có nFe3+ = 0,4 mol. Xảy ra các quá trình sau:
PTHH: Zn + 2Fe3+ → Zn2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: 0,1 → ?(mol)
=>nFe3+ = 0,1.2110,1.2 = 0,2(mol)
PTHH: Cu + 2Fe3+ → Cu2+ + 2Fe2+
TPT: 1mol 2mol
TĐB: ?(mol) ← 0,2(mol)
=> nCu= 0,2.12=0,1(���)20,2.1=0,1(mol)
⇒ m = mCu dư = 0,1 × 64 = 6,4 g
tick giúp tớ, cảm ơn bạn
Theo đề gọi \(n_{Zn}=x\left(mol\right),n_{Cu}=2x\left(mol\right)\)
Có:
\(m_{Zn}+m_{Cu}=19,3\\ \Leftrightarrow65x+64.2x=19,3\\ \Rightarrow x=0,1\)
=> Dung dịch sau \(\left\{{}\begin{matrix}SO_4^{2-}=0,6\\Fe^{2+}=0,4\\Zn^{2+}=0,1\\Cu^{2+}=0,1\end{matrix}\right.\)
\(\Rightarrow m_{kim.loại}=m_{Cu}=0,1.64=6,4\left(g\right)\)