Cho hỗn hợp A gồm FeCO3 và FeS2 tác dụng hoàn toàn với dung dịch HNO3 dư, thu được hỗn hợp khí B gồn CO2 và NO2 dung dịch C chứa Fe(NO3)3 ,H2SO4 và HNO3 . Biết tỉ khối của B đối với O2 bằng 1,425. Viết các phương trình phản ứng và tinhs % số mol các chất trong A
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

15 tháng 11 2019
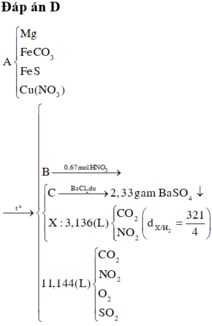
Đáp án : D
Xét X : có nX = 0,14 mol ; MX = 321/7g
Áp dụng qui tắc đường chéo => nCO2 = 0,01 mol ; nNO2 = 0,13 mol
Kết tủa 2,33g chính là BaSO4 => nBaSO4 = nSO2 = 0,01 mol
Khi khí B + HNO3 :
4NO2 + O2 + 2H2O -> 4HNO3
,x -> 0,25x
=> nB = nSO2 + nCO2 + nNO2 + nO2
=> 0,495 = 0,01 + 0,01 + 0,13 + x + 0,25x
=> x = 0,276 mol
Bảo toàn nguyên tố :
,nFeCO3 = nCO2 = 0,01 ; nCu(NO3)2 = ½nNO2 = 0,203 mol
=> nO(X) = 3nFeCO3 + 6nCu(NO3)2 = 1,248 mol
Vì %mO = 47,818% => m = 41,76g



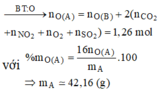

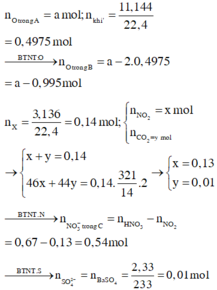

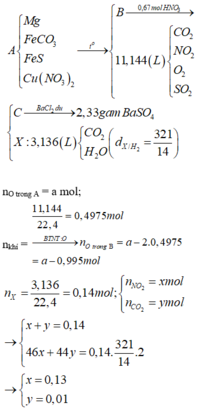
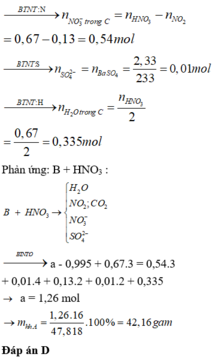

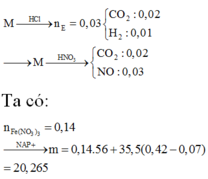
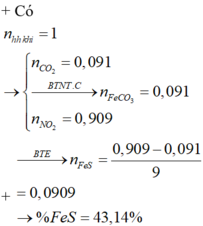
\(n_{CO_2}=a;n_{NO_2}=b;M_B=1,425.32=45,6\left(g\cdot mol^{^{ }-1}\right)\)
Từ sơ đồ đường chéo, rút ra được:
\(\dfrac{a}{b}=\dfrac{1}{4}\\ b=4a\\ n_{FeCO_3}=n_{CO_2}=a\left(mol\right)\\BTe^{^{ }-}:a+15n_{FeS_2}=b\\ n_{FeS_2}=\dfrac{b-a}{15}=\dfrac{3a}{15}=0,2a\left(mol\right)\\ \%n_{FeCO_3}=\dfrac{a}{a+0,2a}.100\%=83,33\%\\ \%n_{FeS_2}=16,67\%\)
Phương trình thiếu sản phẩm H2SO4, FeCO3 + HNO3 dư cho ra muối Fe 3+ và NO2.
Rồi đáp án cuối cùng là gì?