Cho 14,4g sắt (II) oxit tác dụng hoàn toàn với khí Hidro, đun nóng. a. Tính thể tích hidro cần dùng ở đktc? b. Tính khối lượng kim loại tạo thành
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{FeO}=\dfrac{32}{72}=\dfrac{4}{9}\left(mol\right)\)
\(FeO+H_2\underrightarrow{^{t^0}}Fe+H_2O\)
\(\dfrac{4}{9}.....\dfrac{4}{9}....\dfrac{4}{9}\)
\(V_{H_2}=\dfrac{4}{9}\cdot22.4=10\left(l\right)\)
\(m_{Fe}=\dfrac{4}{9}\cdot56=24.89\left(g\right)\)

\(n_{CuO}=\dfrac{16}{80}=0.2\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(0.2.......0.2......0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{Cu}=0.2\cdot64=12.8\left(g\right)\)
\(2Cu+O_2\underrightarrow{^{t^0}}2CuO\)
\(0.2......0.1\)
\(V_{kk}=5V_{O_2}=5\cdot0.1\cdot22.4=11.2\left(l\right)\)

\(n_{Ag_2O}=\dfrac{23.2}{232}=0.1\left(mol\right)\)
\(Ag_2O+H_2\underrightarrow{^{t^0}}2Ag+H_2O\)
\(0.1......0.1.........0.2\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{Ag}=0.2\cdot108=21.6\left(g\right)\)
\(4Ag+O_2\underrightarrow{^{t^0}}2Ag_2O\)
\(0.2.....0.05\)
\(V_{kk}=5V_{O_2}=5\cdot0.05\cdot22.4=5.6\left(l\right)\)

\(n_{H_2O}=\dfrac{14,4}{18}=0,8mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,8 0,8 0,8 ( mol )
\(m_{Na}=0,8.23=18,4g\)
\(m_{NaOH}=0,8.40=32g\)
Số mol của nước là:
nH2O=14,4/18=0,8(mol)
PTHH: Na+H2O→NaOH+1/2H2
0,8 0,8 0,8 0,4 ( mol)
a) Thể tích khí Hidro tạo thành(ĐKTC) là:
VH2=0,4*22,4= 8,96(l)
b) Khối lượng Natri là:
mNa=0,8*23 =18,4(g)
Khối lượng Bazơ tạo thành sau phản ứng là:
mNaOH=0,8*40=32(g)

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
Ta có: \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=0,3\left(mol\right)\\n_{FeCl_2}=n_{Fe}=0,15\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{HCl}=0,3\cdot36,5=10,95\left(g\right)\\m_{Fe}=0,15\cdot56=8,4\left(g\right)\\m_{FeCl_2}=0,15\cdot127=19,05\left(g\right)\end{matrix}\right.\)
PTHH: Fe+2HCl→FeCl2+H2↑Fe+2HCl→FeCl2+H2↑
Ta có: nH2=3,3622,4=0,15(mol)nH2=3,3622,4=0,15(mol)
⇒{nHCl=0,3(mol)nFeCl2=nFe=0,15(mol)⇒{nHCl=0,3(mol)nFeCl2=nFe=0,15(mol) ⇒⎧⎪⎨⎪⎩mHCl=0,3⋅36,5=10,95(g)mFe=0,15⋅56=8,4(g)mFeCl2=0,15⋅127=19,05(g)⇒{mHCl=0,3⋅36,5=10,95(g)mFe=0,15⋅56=8,4(g)mFeCl2=0,15⋅127=19,05(g)

PT: Fe2O3+3H2to→2Fe+3H2O
CuO+H2to→Cu+H2O
a, Ta có: mFe2O3=20.60%=12(g)
⇒nFe2O3=\(\dfrac{12}{160}\)=0,075(mol
mCuO=20−12=8(g
⇒nCuO=\(\dfrac{8}{80}\)=0,1(mol)
Theo pT:
nFe=2nFe2O3=0,15(mol)
nCu=nCuO=0,1(mol)
⇒mFe=0,15.56=8,4(g)
mCu=0,1.64=6,4(g)
b, Theo PT: nH2=3nFe2O3+nCuO=0,325(mol)
⇒VH2=0,325.22,4=7,28(l)
c. Zn+2HCl->ZnCl2+H2
0,65----------0,325
=>m HCl=0,65.36,5=23,725g
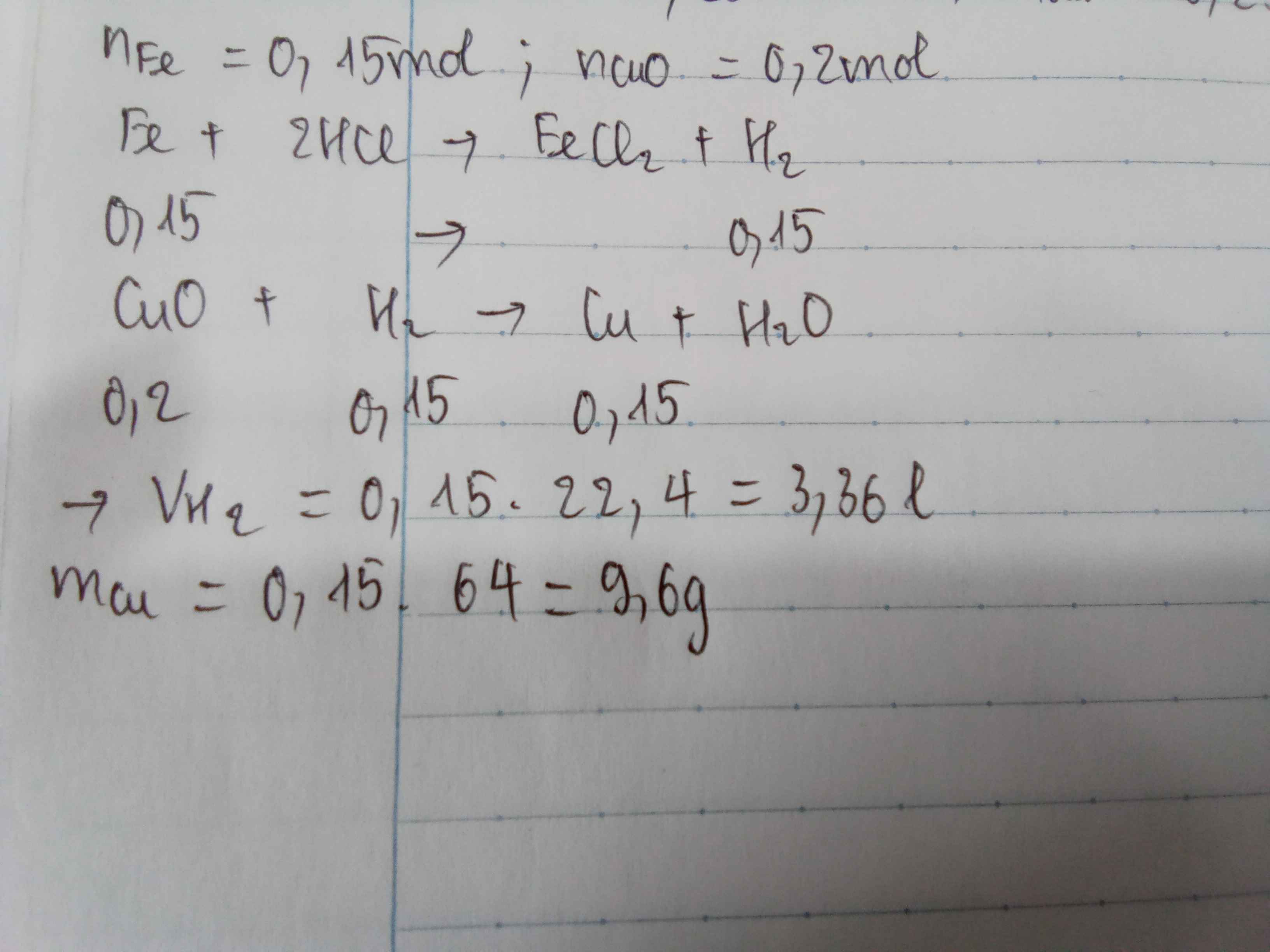

\(n_{FeO}=\dfrac{14.4}{72}=0.2\left(mol\right)\)
\(FeO+H_2\underrightarrow{^{t^0}}Fe+H_2O\)
\(0.2.....0.2......0.2\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)
\(m_{Fe}=0.2\cdot56=11.2\left(g\right)\)
nFeO=0,2(mol)
a) PTHH: FeO + H2 -to-> Fe + H2O
0,2___________0,2______0,2(mol)
V(H2,đktc)=0,2.22,4=4,48(l)
b) mFe=0,2.56=11,2(g)