Hấp thụ hết 2,688 lit CO2 (đktc) vào cốc đựng 150 gam dung dịch KOH a% thu được 11,4 gam muối. Tính a và nồng độ % các chất trong dung dịch thu được sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nCO2= 2,464/22,4= 0,11(mol)
a) PTHH: KOH + CO2 -> KHCO3
nKHCO3=nKOH= nCO2 = 0,11(mol) => VddKOH(min)= 0,11/1,5=11/150(l)\(\approx\)0,073(l)
b) 2 KOH + CO2 -> K2CO3 + H2O
nKOH=2.nCO2= 0,22(mol)
=> VddKOH(max)= 0,22/1.5= 11/75(l)\(\approx\) 0,147(l)
c) 2 KOH + CO2 -> K2CO3 + H2O
x__________0,5x__0,5x(mol)
KOH + CO2 -> KHCO3
y___y___________y(mol)
Ta có:
nCO2(tổng)=0,11 <=> 0,5x+y=0,11 (a)
Mặt khác: m(muối)= 13,85
<=> mK2CO3+mKHCO3=13,85
<=> 138.0,5x+100.y=13,85
<=> 79x+100y=13,85 (b)
Từ (a), (b), ta được hpt:
\(\left\{{}\begin{matrix}0,5x+y=0,11\\79x+100y=13,85\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=\frac{57}{580}\\y=\frac{353}{5800}\end{matrix}\right.\)
=> \(V_{ddKOH}=\frac{\frac{57}{580}+\frac{353}{5800}}{1,5}\approx0,106\left(l\right)\)

Muối có thể có NaHCO3, hoặc Na2CO3 hoặc cả hai
Đặt số mol NaHCO3, Na2CO3 lần lượt là x,y(mol)
Theo đề ta có hệ phương trình:
\(\left\{{}\begin{matrix}x+y=0,1025\\84x+106y=9,435\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,065\left(mol\right)\\y=0,0375\left(mol\right)\end{matrix}\right.\)
BT Na: \(\dfrac{100.a\%}{40.100\%}=0,065+0,0375.2\Rightarrow a=5,6\)
\(C\%_{NaHCO_3}=\dfrac{0,065.84}{100}.100\%=5,46\%\)
\(C\%_{Na_2CO_3}=\dfrac{106.0,0375}{100}.100\%=3,975\%\)

nCO2=0,15mol
nNa2CO3=0,25mol
PTHH: CO2+2NaOH=>Na2CO3 + H2O
0,15: 0,25 =>nNa2CO3 dư
p/ư: 0,15----0,3---------->0,15
=>V=0,3:1,2=0.25lit
=> CM(Na2CO3)=0,15:0,25=0,6M

Ta có:
nCO2=6,72\22,4=0,3 mol
;nNaOH=0,5.1=0,5
Ta có:
nNaOHnCO2=0,5\0,3=1,67
Nên phản ứng tạo ra 2 muối
2NaOH+CO2→Na2CO3+H2O
NaOH+CO2→NaHCO3
Ta có:
nNa2CO3=nNaOH−nCO2=0,5−0,3=0,2 mol;
nNaHCO3=0,3−0,2=0,1 mol
→CM Na2CO3=0,20,5=0,4M;CM NaHCO3=0,10,5=0,2M
BaCl2+Na2CO3→BaCO3+2NaCl
→nBaCO3=nNa2CO3=0,2 mol
→m=mBaCO3=0,2.197=39,4 gam

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_{BaCO_3}=\dfrac{5,91}{197}=0,03\left(mol\right)\)
Đun nóng dung dịch A lại thu được kết tủa, chứng tỏ A có \(Ba\left(HCO_3\right)_2\)
\(Ba\left(OH\right)_2+CO_2\rightarrow BaCO_3+H_2O\\ Ba\left(OH\right)_2+2CO_2\rightarrow Ba\left(HCO_3\right)_2\)
Ta có:
\(n_{BaCO_3}+2n_{Ba\left(HCO_3\right)_2}=n_{CO_2}\\ \Rightarrow n_{Ba\left(HCO_3\right)_2}=\dfrac{0,1-0,03}{2}=0,035\left(mol\right)\\ n_{Ba\left(OH\right)_2}=n_{BaCO_3}+n_{Ba\left(HCO_3\right)_2}=0,035+0,03=0,065\left(mol\right)\\ \Rightarrow a=\dfrac{0,065}{2}=0,325M\)
\(Ba\left(HCO_3\right)_2\rightarrow BaCO_3+CO_2+H_2O\)
\(n_{BaCO_3}=n_{Ba\left(HCO_3\right)_2}=0,035\left(mol\right)\\ \Rightarrow m=0,035\cdot197=6,895\left(g\right)\)

Ta có: \(\left\{{}\begin{matrix}n_{CO_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\\n_{CaCO_3}=\dfrac{3}{100}=0,03\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo 2 muối
PTHH: \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3\downarrow+H_2O\) (1)
\(2CO_2+Ca\left(OH\right)_2\rightarrow Ca\left(HCO_3\right)_2\) (2)
Theo PTHH: \(n_{Ca\left(OH\right)_2\left(1\right)}=n_{CaCO_3}=0,03\left(mol\right)=n_{CO_2\left(1\right)}\)
\(\Rightarrow n_{CO_2\left(2\right)}=0,04-0,03=0,01\left(mol\right)\) \(\Rightarrow n_{Ca\left(OH\right)_2\left(2\right)}=0,005\left(mol\right)\)
\(\Rightarrow\Sigma n_{Ca\left(OH\right)_2}=0,03+0,005=0,035\left(mol\right)\) \(\Rightarrow x=C_{M_{Ca\left(OH\right)_2}}=\dfrac{0,035}{0,5}=0,07\left(M\right)\)
Ta có: \(n_{CO_2}=\dfrac{0,896}{22,4}=0,04\left(mol\right)\)
\(n_{CaCO_3}=\dfrac{3}{100}=0,03\left(mol\right)\)
PTHH: CO2 + Ca(OH)2 ---> CaCO3↓ + H2O
Ta thấy: \(\dfrac{0,04}{1}>\dfrac{0,03}{1}\)
Vậy CO2 dư.
Theo PT: \(n_{Ca\left(OH\right)_2}=n_{CaCO_3}=0,03\left(mol\right)\)
Đổi 500ml = 0,5 lít.
=> \(C_{M_{Ca\left(OH\right)_2}}=x=\dfrac{0,03}{0,5}=0,06M\)
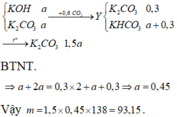
Chị nghĩ đề là 2,24 sẽ hợp lý hơn nhé! Còn nếu em vẫn để số liệu là 2,688 thì hướng làm vẫn như vậy chỉ là số liệu khác nhưng mà chị tính hiện tại theo số liệu của em thì không ra.
Bài làm
\(\begin{array}{l}
{n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1mol\\
C{O_2} + KOH \to KHC{O_3}\\
C{O_2} + 2KOH \to {K_2}C{O_3}\\
hh:KHC{O_3}(a\,mol),{K_2}C{O_3}(b\,mol)\\
\left\{ \begin{array}{l}
a + b = 0,1mol\\
100a + 138b = 11,4
\end{array} \right.\\
\Rightarrow a = 0,06;b = 0,04\\
{n_{KOH}} = {n_{KHC{O_3}}} + 2{n_{{K_2}C{O_3}}} = 0,14mol\\
{m_{KOH}} = 0,14 \times 56 = 7,84g\\
C{\% _{KOH}} = \dfrac{{7,84}}{{150}} \times 100\% = 5,227\% \\
C{\% _{KHC{O_3}}} = \dfrac{{0,06 \times 100}}{{0,1 \times 44 + 150}} \times 100\% = 3,88\% \\
C{\% _{{K_2}C{O_3}}} = \dfrac{{0,04 \times 138}}{{0,1 \times 44 + 150}} \times 100\% = 3,575\%
\end{array}\)