Cho kẽm dư tác dụng với 100 ml dung dịch HCl 5M. Thu được V lít khí.(đktc) - Tính C% của dung dịch sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Xét trong 100 ml dung dịch X: 2H⁺ + CO32– → CO2 + H2O ⇒ nCO32– = nkhí = 0,1 mol.
Ba2+ + CO32– → BaCO3 || Ba2+ + SO42– → BaSO4 ⇒ nSO42– = (43 - 0,1 × 197) ÷ 233 = 0,1 mol.
NH4+ + OH– → NH3 + H2O ⇒ nNH4+ = nNH3 = 0,4 ÷ 2 = 0,2 mol.Bảo toàn điện tích: nNa+ = 0,2 mol.
⇒ mmuối trong 300ml X = 3 × (0,2 × 23 + 0,2 × 18 + 0,1 × 60 + 0,1 × 96) = 71,4(g) ⇒ chọn C.

\(HCl+NaHCO_3\rightarrow NaCl+CO_2+H_2O\\ N_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ m_{HCl}=n_{CO_2}=0,2\left(mol\right)\\ V_{ddHCl}=\dfrac{112}{1,12}=100\left(ml\right)=0,1\left(l\right)\\ \Rightarrow C_{MddHCl}=\dfrac{0,2}{0,1}=2\left(M\right)\\ m_{HCl}=0,2.36,5=7,3\left(g\right)\\ C\%_{ddHCl}=\dfrac{7,3}{112}.100\approx6,518\%\)
\(n_{CO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: NaHCO3 + HCl --> NaCl + CO2 + H2O
0,2<------------0,2
=> \(C\%\left(HCl\right)=\dfrac{0,2.36,5}{112}.100\%=6,518\%\)
\(V_{ddHCl}=\dfrac{112}{1,12}=100\left(ml\right)=0,1\left(l\right)\)
=> \(C_M\left(HCl\right)=\dfrac{0,2}{0,1}=2M\)

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn A
Gọi số mol Na + , NH 4 + , CO 3 2 - và SO 4 2 - trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
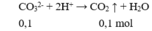
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
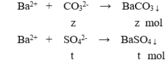
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
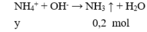
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.

Đáp án : A
Trong 100 ml X : nCO3 = nCO2 = 0,1 mol
, mkết tủa = mBaCO3 + mBaSO4 = 43 => nSO4 = 0,1 mol
Trong 200 ml X : nNH3 = nNH4 = 0,4 mol
=> Trong 300 ml X có : 0,3 mol CO32- ; 0,3 mol SO42- ; 0,6 mol NH4+ và 0,6 mol Na+ ( BT điện )
=> mmuối = 71,4g
Đề có thiếu gì không em nhỉ ? khối lượng riêng của HCl ?
nHCl=0,1.5=0,5(mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
nZn=nZnCl2=nH2=nHCl/2=0,5/2=0,25(mol)
mZnCl2=0,25.136=34(g)
Mà em ơi không cho khối lượng riêng dd HCl à e,?