Dùng 6,5 gam kẽm phản ứng với 100g dung dịch axit clohidric nồng độ 14,6%. a. Viết phương trình phản ứng xảy ra? b. Tính thể tích khí sinh ra (đktc)? c. Tính nồng độ phần trăm của các chất có trong dung dịch khi phản ứng kết thúc? (Cho biết: Cl=35,5; H= 1; Zn = 65)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{H_2SO_4}=147.10\%=14,7\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,1 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) ⇒ Zn hết, H2SO4 dư
b) \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) mdd sau pứ = 6,5 + 147 - 0,1.2 = 153,3 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,1.161.100\%}{153,3}=10,502\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,15-0,1\right).98.100\%}{153,3}=3,196\%\)

nZn=0,1 mol
Zn +2HCl=> ZnCl2+ H2
0,1 mol =>0,2 mol
=>mHCl=36,5.0,2=7,3g
=>m dd HCl=7,3/14,6%=50g
mdd sau pứ=6,5+50-0,1.2=56,3g
=>C% dd ZnCl2=(0,1.136)/56,3.100%=24,16%
a.b. Zn + 2HCl ---> ZnCl2 + H2 (1)
Theo pt: 65g 73g 136g 2g
Theo đề: 6,5g 7,3g 13,6g
=> mddHCl=\(\frac{7,3.100}{14,6}=50\left(g\right)\)
c. Từ pt (1), ta có: \(C_{\%}=\frac{13,6}{50+6,5}.100\%=24,1\%\)
![]()

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{HCl}=\dfrac{100\cdot14.6\%}{36.5}=0.4\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(1........2\)
\(0.1......0.4\)
\(LTL:\dfrac{0.1}{1}< \dfrac{0.4}{2}\Rightarrow HCldư\)
\(V_{H_2}=0.1\cdot22.4=2.24\left(l\right)\)
\(m_{\text{dung dịch sau phản ứng}}=6.5+100-0.1\cdot2=106.3\left(g\right)\)
\(C\%ZnCl_2=\dfrac{0.1\cdot136}{106.3}\cdot100\%=12.79\%\)
\(C\%HCl\left(dư\right)=\dfrac{\left(0.4-0.2\right)\cdot36.5}{106.3}\cdot100\%=6.87\%\%\)

a, Zn + 2HCl ----> ZnCl2 + H2↑
b, nZn= 6,5:65= 0,1 mol; nHCl= (100*14,6%)/36,5 = 0,4 mol
Zn + 2HCl ----> ZnCl2 + H2↑
trc pư: 0,1 0,4 (mol)
pư: 0,1 0,2 (mol)
sau pư:0 0,2 0,1 0,1 (mol)
VH2(dktc)= 0,1*22,4= 2,24 (L)
c, mZnCl2= 0,1* 136= 13,6 g
mHCl= 0,2* 36,5= 7,3 g
mdd = 6,5 +100 - 0,1*2 =106,3 g
C%ZnCl2= 13,6/106,3* 100%= 12,8%
C%HCl= 7,3/106,3*100%=6,8%

a , PTHH : Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
Số mol của Zn là :
nZn = \(\frac{m_{Zn}}{M_{Zn}}\)= 0,2 mol
Ta có : Zn + 2HCl \(\rightarrow\)ZnCl2 + H2
Cứ : 1 mol 1mol 1 mol
Vậy : 0,2 mol 0,2 mol 0,2 mol
Thể tích H2 sinh ra :
VH2 = n . 22,4 = 0,2 . 22,4 = 4,48 l
c, Khối lượng của ZnCl2 là :
m = n . M = 0,2 . 136 = 27, 2 g
Khối lượng của dung dịch là :
mdd = m Zn + mHCl - mH2 = 13 + 100 - ( 0,2 . 2 ) = 112,6 g
Nồng độ phần trăm các chất còn lại sau phản ứng :
C % = \(\frac{m_{ZnCl2}}{m_{dd}}\).100 % = \(\frac{27,2}{112,6}\). 100 % \(\approx\)24,16%

\(n_{Zn}=\dfrac{6.5}{65}=0.1\left(mol\right)\)
\(n_{H_2SO_4}=0.3\cdot1=0.3\left(mol\right)\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(0.1........0.1...........0.1.......0.1\)
\(\Rightarrow H_2SO_4dư\)
\(n_{H_2SO_4\left(dư\right)}=0.3-0.1=0.2\left(mol\right)\)
\(n_{ZnSO_4}=n_{H_2}=0.1\left(mol\right)\)
\(C_{M_{ZnSO_4}}=\dfrac{0.1}{0.3}=0.33\left(M\right)\)
\(C_{M_{H_2SO_4\left(dư\right)}}=\dfrac{0.2}{0.3}=0.66\left(M\right)\)
\(a) Zn + H_2SO_4 \to ZnSO_4 + H_2\\ b) n_{Zn} = \dfrac{6,5}{65} = 0,1 < n_{H_2SO_4} =0,3 \to H_2SO_4\ dư\\ n_{H_2SO_4\ pư} = n_{ZnSO_4} = n_{Zn} = 0,1(mol)\\ n_{H_2SO_4\ dư} = 0,3 - 0,1 = 0,2(mol)\\ c) C_{M_{ZnSO_4}} = \dfrac{0,1}{0,3} = 0,33M\\ C_{M_{H_2SO_4}} = \dfrac{0,2}{0,3} = 0,67M\)

a) Zn + 2HCl → ZnCl2 + H2
b) n H2 = n Zn = 1,95/65 = 0,03(mol)
V H2 = 0,03.22,4 = 0,672(lít)
c) n ZnCl2 = n Zn = 0,03(mol)
=> m dd sau pư = 1,95 + 120 - 0,03.2 = 121,89(gam)
C% ZnCl2 = 0,03.136/121,89 .100% = 3,35%
a) nZn=0,03(mol)
PTHH: Zn + 2 HCl -> ZnCl2 + H2
nH2=nZnCl2=nZn=0,03(mol)
b) V(H2,đktc)=0,03.22,4=0,672(l)
c) mZnCl2=136.0,03=4,08(g)
mddA=mddZnCl2=1,95+ 120 - 0,03.2= 121,89(g)
=> C%ddZnCl2=(4,08/121,89).100=3,347%
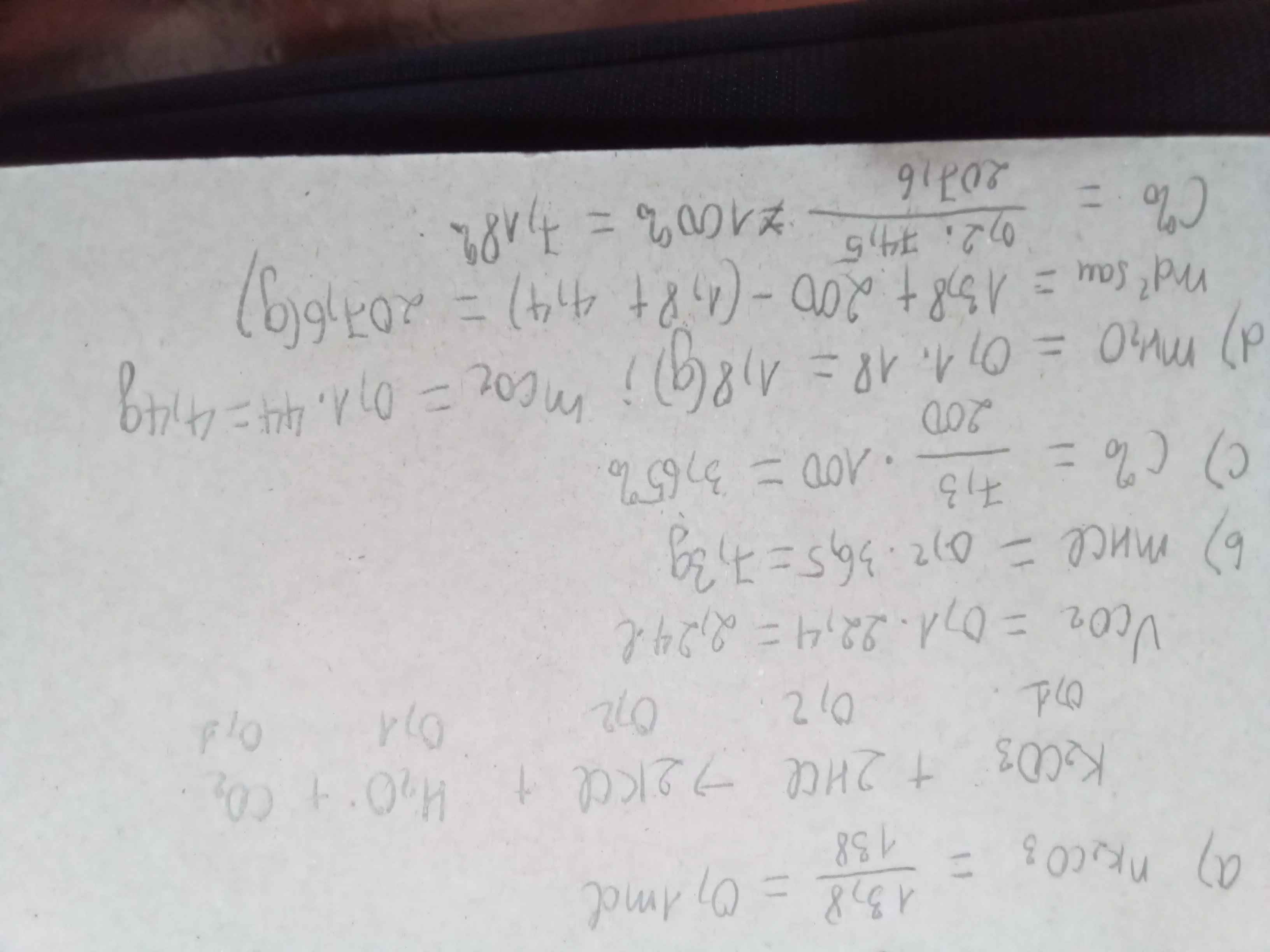
a, \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{HCl}=100.14,6\%=14,6\left(g\right)\Rightarrow n_{HCl}=\dfrac{14,6}{36,5}=0,4\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,4}{2}\), ta được HCl dư.
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, Theo PT: \(\left\{{}\begin{matrix}n_{HCl\left(pư\right)}=2n_{Zn}=0,2\left(mol\right)\\n_{ZnCl_2}=n_{Zn}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{HCl\left(dư\right)}=0,4-0,2=0,2\left(mol\right)\)
Ta có: m dd sau pư = 6,5 + 100 - 0,1.2 = 106,3 (g)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{ZnCl_2}=\dfrac{0,1.136}{106,3}.100\%\approx12,79\%\\C\%_{HCl\left(dư\right)}=\dfrac{0,2.36,5}{106,3}.100\%\approx6,87\%\end{matrix}\right.\)
Em cảm ơn idol