Chia m gam hỗn hợp X gồm Fe và Al thành hai phần bằng nhau. Biết các khí đều đo ở điều kiện tiêu chuẩn. Tính m. - Cho phần hai vào dung dịch NaOH dư, thu được 10,08 lít khí Hạ. - Cho phần một vào một lượng dư dung dịch HCl, thu được 13,44 lít khí H2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn đáp án C
R là Natri (Na) và M là Nhôm (Al). Do số mol H2 ở 2 thí nghiệm khác nhau.
• phần 1: Al dư. Quy V lít về V mol. Xét phần 1 : Do Al dư ⇒ nAl phản ứng = nNa
⇒ Bảo toàn electron: nNa + 3nNa = 2nH2 ⇒ nNa = 2V ÷ 4 = 0,5V mol.
• Phần 2: NaOH dư ⇒ Al phản ứng hết. Bảo toàn electron:
nNa + 3nAl = 2nH2 ⇒ 0,5V + 3nAl = 2 × 1,45V ⇒ nAl = 0,8V mol.
⇒ nR : nM = 0,5 : 0,8 = 5 : 8

Chọn đáp án C
R là Natri (Na) và M là Nhôm (Al). Do số mol H2 ở 2 thí nghiệm khác nhau.
• phần 1: Al dư. Quy V lít về V mol. Xét phần 1 : Do Al dư ⇒ nAl phản ứng = nNa
⇒ Bảo toàn electron: nNa + 3nNa = 2nH2 ⇒ nNa = 2V ÷ 4 = 0,5V mol.
• Phần 2: NaOH dư ⇒ Al phản ứng hết. Bảo toàn electron:
nNa + 3nAl = 2nH2 ⇒ 0,5V + 3nAl = 2 × 1,45V ⇒ nAl = 0,8V mol.
⇒ nR : nM = 0,5 : 0,8 = 5 : 8.





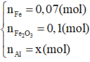
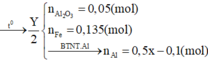
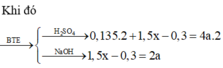
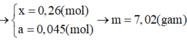
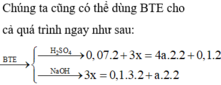
Phần hai :
$2NaOH+ 2Al + 2H_2O \to 2NaAlO_2 + 3H_2$
$n_{H_2} = \dfrac{10,08}{22,4} = 0,45(mol)$
Theo PTHH : $n_{Al} = \dfrac{2}{3}n_{H_2} = 0,3(ol)$
Phần một :
$2Al + 6HCl \to 2AlCl_3 + 3H_2$
$Fe + 2HCl \to FeCl_2 + H_2$
$n_{H_2} = \dfrac{13,44}{22,4} = 0,6(mol)$
Theo PTHH : $n_{H_2} = \dfrac{3}{2}n_{Al} + n_{Fe}$
$\Rightarrow n_{Fe} = 0,15(mol)$
$\Rightarrow m = 2(0,3.27 + 0,15.56) = 33(gam)$