Cho a gam bột Fe tác dụng với b gam bột S, sau một thời gian thu được 12,24g hỗn hợp X gồm FeS, Fe và S. Cho X tác dụng với lượng du dung dịch HCl, sau khi các phản ứng xảy ra hoàn toàn thu được dung dịch Y và 1,28g S không tan và 3,36l hỗn hợp khí Z (đktc) gồm H2S và H2 a) Tính giá trị của a và b b) Tính hiệu suất phản ứng giữa Fe và S
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

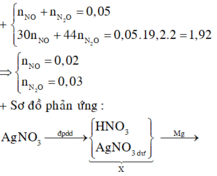
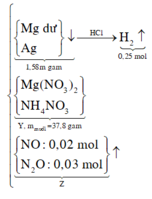

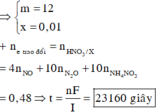
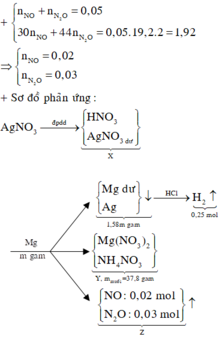

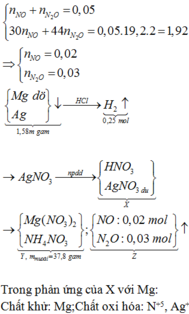

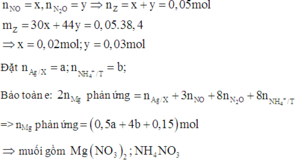
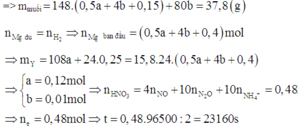



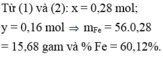
a, PT: \(Fe+S\underrightarrow{t^o}FeS\) (1)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{FeS}=y\left(mol\right)\end{matrix}\right.\) ⇒ 56x + 88y = 12,24 - 1,28 (1)
Theo PT: \(n_{H_2S}+n_{H_2}=n_{FeS}+n_{Fe}=y+x=\dfrac{3,36}{22,4}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,07\left(mol\right)\\y=0,08\left(mol\right)\end{matrix}\right.\)
Theo PT: \(n_{Fe\left(1\right)}=n_{S\left(1\right)}=n_{FeS}=0,08\left(mol\right)\)
⇒ nFe (ban đầu) = 0,08 + 0,07 = 0,15 (mol) ⇒ a = mFe = 0,15.56 = 8,4 (g)
mS = 0,08.32 + 1,28 = 3,84 (g)
b, nS = 3,84:32 = 0,12 (mol)
Xét tỉ lệ: \(\dfrac{0,15}{1}>\dfrac{0,12}{1}\), ta được Fe dư nếu pư hết.
Theo PT: \(n_{FeS\left(LT\right)}=n_S=0,12\left(mol\right)\)
\(\Rightarrow H=\dfrac{0,08}{0,12}.100\%\approx66,67\%\)