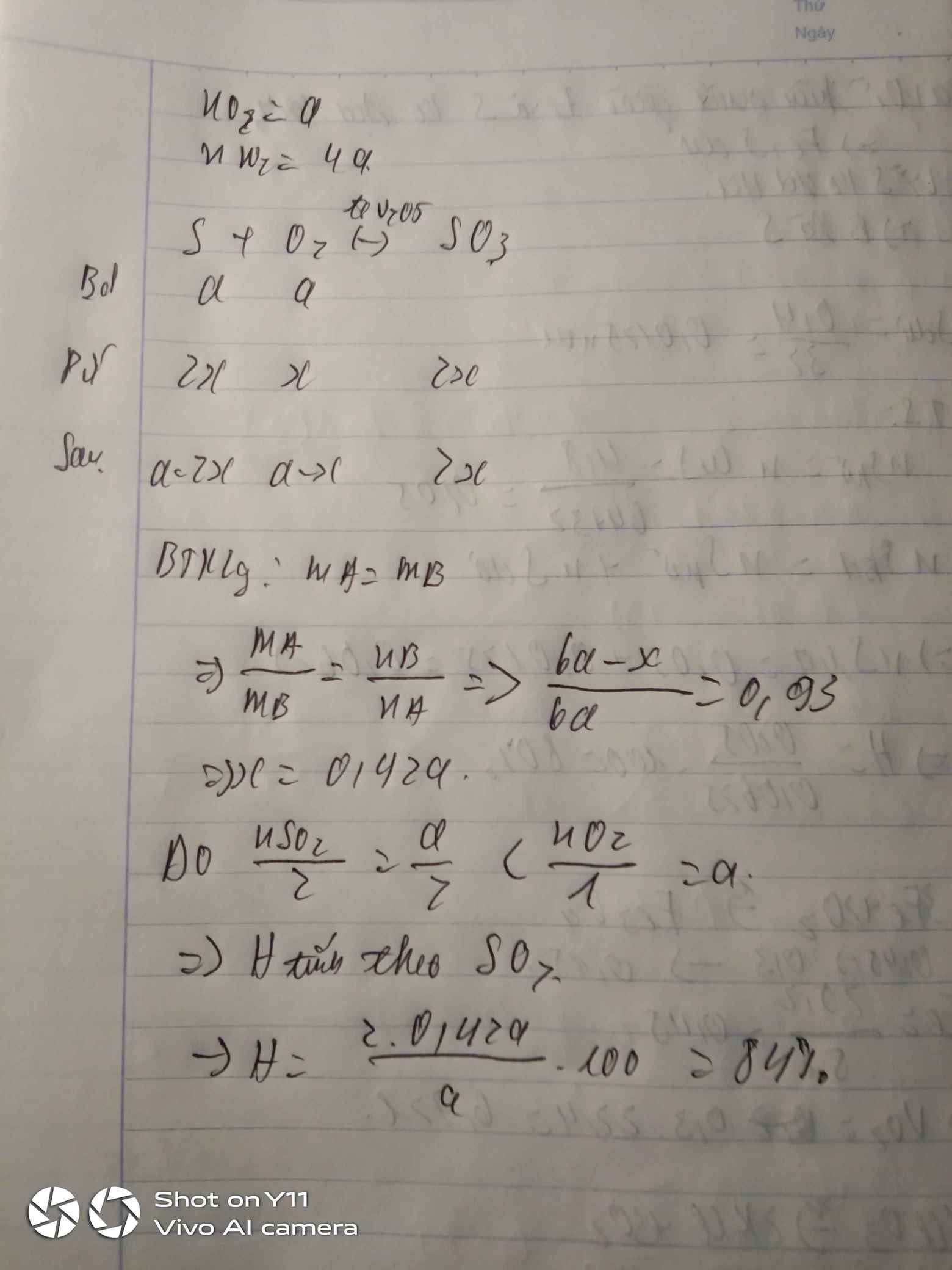Câu 7. Trộn khí SO2 và khí O2 thành hỗn hợp X có khối lượng mol trung bình 48 gam. Cho một ít V2O5 vào trong hỗn hợp X, nung nóng hỗn hợp đến 400°C thì thu được hỗn hợp khí Y. Biết hiệu suất phản ứng là 80%. Tính % V của SO3 trong hỗn hợp khí Y là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong hỗn hợp Y: Đặt
![]()
Vì SO2 dư nên kết tủa Z gồm BaSO4 và BaSO3
Ta có:
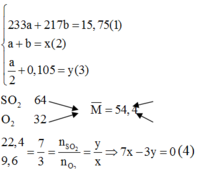


ttheo đề ta có:
\(nMg=0,6\left(mol\right);nSO_2=0,6\left(mol\right)\)
pthh:
\(SO_2+2Mg\rightarrow S+2MgO\)
Chất rắn D gồm MgO và S
\(MgO+2HNO_3\rightarrow Mg\left(NO_3\right)_2+H_2O\)
\(S+6HNO_3\rightarrow H_2SO_4+6NO_2+2H_2O\)
\(nNO_2=n_S.6=0,6.6=3,6\left(mol\right)\Rightarrow VNO_2=3,6.22,4=80,64\left(lít\right)\)
Khi cho \(Ba\left(OH\right)_2\) vào Y thu được kết tủa gồm \(Mg\left(OH\right)_2vàBaSO_4\)
\(m\downarrow=0,6.58+0,6.233=174,6\left(g\right)\)
=> Hiệu suất tổng hợp của SO3 là 62,5%

Ta có : = =1
+→
2x → x → 2x
Hỗn hợp khí gồm dư ( 1 - 2x ) , dư ( 1 - x ) và ( 2x )
⇒ 2x =35,3 % (1 - 2x + 1 - x + 2x )
⇔ x=0,3
Hiệu Suất :
H = ×100 = × 100 = 60%

Hỗn hợp A ban đầu có SO2 : a mol, N2: 4a mol và O2: a mol.
Phản ứng:
2SO2 + O2< --> 2SO3 (XT: V2O5, t0) (1)
Gọi số mol SO2 phản ứng là x.
Theo (1): Số mol giảm = số mol O2 phản ứng = 0,5x mol
=> nB = 6a – 0,5x mol
Theo định luật bảo toàn khối lượng: mA = mB = m
\(d_{A/B}=\dfrac{m}{6a}:\dfrac{m}{6a-0,5x}=\dfrac{6a-0,5x}{6a}=0,93\)
\(\Rightarrow\dfrac{x}{a}=0,84\)
\(VậyH\%=84\%\)

1)
Xét tỉ lệ: \(\dfrac{3}{2}< \dfrac{2}{1}\) => Hiệu suất tính theo SO2
\(n_{SO_2\left(pư\right)}=\dfrac{3.75}{100}=2,25\left(mol\right)\)
PTHH: 2SO2 + O2 -----V2O5,to-----> 2SO3
2,25--------------------->2,25
=> nSO3 = 2,25 (mol)
2) Gọi số mol SO2 pư là a (mol)
PTHH: 2SO2 + O2 -----V2O5,to-----> 2SO3
Trc pư: 3 2 0
Pư: a-->0,5a-------------------->a
Sau pư: (3-a) (2-0,5a) a
=> (3-a) + (2-0,5a) + a = 4,25
=> a = 1,5 (mol)
=> \(H=\dfrac{1,5}{3}.100\%=50\%\)