Trong 26 g Zn bỏ vào bình chứa dung dịch H2SO4 dư Sau khi phản ứng kết thúc thì thu được 6,72 lít H2 ở điều kiện tiêu chuẩn Tính khối lượng tạp chất có trong miếng Zn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\) (1)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\) (2)
b) Vì H2SO4 chắc chắn còn dư nên tính theo mol của H2
Ta có: \(n_{H_2}=\dfrac{0,224}{22,4}=0,01\left(mol\right)\)
Gọi số mol của Zn là \(a\) \(\Rightarrow n_{H_2\left(1\right)}=a\left(mol\right)\)
Gọi số mol của Mg là \(b\) \(\Rightarrow n_{H_2\left(2\right)}=b\left(mol\right)\)
Ta lập được hệ phương trình:
\(\left\{{}\begin{matrix}a+b=0,01\\65a+24b=0,445\end{matrix}\right.\) \(\Leftrightarrow\left\{{}\begin{matrix}a=0,005\\b=0,005\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Zn}=0,005\cdot65=0,325\left(g\right)\\m_{Mg}=0,005\cdot24=0,12\left(g\right)\end{matrix}\right.\)
PTHH Zn+ H2SO4--->ZnSO4 +H2
Mg+H2SO4----->MgSO4+H2
Đặt nZn=a,nMg=b
=>mhh=65a+24b=0,445(I)
Theo các phương trình phản ứng
=>\(n_{H_2}\)=a+b=\(\dfrac{0,224}{22,4}=0,01\)(II)
Từ(I),(II)=>a=b=0.005(mol)
=>mZn=0,005.65=0,325(g)
mMg=0,005.24=0.12(g)

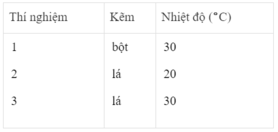
Thể tích khí hiđro :
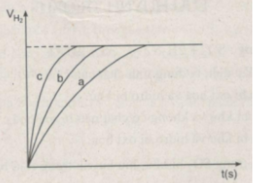
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

Bài 1:
a) nP=6,2/31=0,2(mol); nO2= 6,72/22,4=0,3(mol)
PTHH: 4P + 5 O2 -to-> 2 P2O5
Ta có: 0,2/4 < 0,3/5
=> P hết, O2 dư, tính theo nP
=> nO2(p.ứ)= 5/4. nP= 5/4. 0,2=0,25(mol)
=> mO2(dư)=0,3- 0,25=0,05(mol)
=> mO2(dư)=0,05.32=1,6(g)
b) nP2O5= nP/2= 0,2/2=0,1(mol)
=>mP2O5=0,1.142=14,2(g)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15(mol)\\ PTHH:Zn+H_2SO_4\to ZnSO_4+H_2\\ \Rightarrow n_{Zn}=n_{H_2}=0,15(mol)\\ \Rightarrow \%_{Ag}=\dfrac{20-0,15.65}{20}.100\%=51,25\%\)

Gọi $n_{Fe} = a(mol) ; n_{Zn} = b(mol) \Rightarrow 56a + 65b = 1,77(1)$
$n_{NO_2} = \dfrac{1,792}{22,4} = 0,08(mol)$
Bảo toàn electron :
$3n_{Fe} + 2n_{Zn} = n_{NO_2} \Rightarrow 3a + 2b = 0,08(2)$
Từ (1)(2) suy ra: a = 0,02 ; b = 0,01
$\%m_{Fe} = \dfrac{0,02.56}{1,77}.100\% = 63,3\%$
$\%m_{Zn} =100\% - 63,3\% = 36,7\%$
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
Theo PT: \(n_{Zn}=n_{H_2}=0,3\left(mol\right)\Rightarrow m_{Zn}=0,3.65=19,5\left(g\right)\)
⇒ m tạp chất = 26 - 19,5 = 6,5 (g)