Đốt cháy hoàn toàn 16,8(1) khí metan ở đktc. Tính thể tích khí oxi ở đktc . Tính khối lượng các sản phẩm thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nFe = 16.8/56 = 0.3 (mol)
3Fe + 2O2 -to-> Fe3O4
0.3......0.2...........0.1
VO2 = 0.2*22.4 = 4.48 (l)
mFe3O4 = 0.1*232 = 23.2 (g)

Ta có: \(n_{CH_4}=\dfrac{6,4}{16}=0,4\left(mol\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
___0,4____0,8___0,4____0,8 (mol)
a, Ta có: \(m_{CO_2}=0,4.44=17,6\left(g\right)\)
\(m_{H_2O}=0,8.18=14,4\left(g\right)\)
b, \(V_{O_2}=0,8.22,4=17,92\left(l\right)\)
Bạn tham khảo nhé!

\(n_{CH_4}=\dfrac{V_{CH_4}}{22,4}=\dfrac{5,6}{22,4}=0,25mol\)
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,25 0,5 0,,25 0,5 ( mol )
\(V_{O_2}=n_{O_2}.22,4=0,5.22,4=11,2l\)
\(m_{CO_2}=n_{CO_2}.M_{CO_2}=0,25.44=11g\)
\(m_{H_2O}=n_{H_2O}.M_{H_2O}=0,5.18=9g\)

\(4P+5O_2\xrightarrow{t^o}2P_2O_5\\ n_P=\dfrac{6,2}{31}=0,2(mol)\\ \Rightarrow n_{P_2O_5}=0,1(mol);n_{O_2}=0,25(mol)\\ \Rightarrow m_{P_2O_5}=0,1.142=14,2(g);V_{O_2}=0,25.22,4=5,6(l)\)

a.b.
\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,3 0,2 0,1 ( mol )
\(m_{Fe_3O_4}=0,1.232=23,2g\)
\(V_{O_2}=0,2.22,4=4,48l\)
\(V_{kk}=4,48.5=22,4l\)
c.
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,4 0,2 ( mol )
\(m_{KMnO_4}=\dfrac{0,4.158}{\left(100-20\right)\%}=79g\)
a/ Số mol Fe là : nFe = 16,8: 56 = 0,3 mol
PTPƯ:
3Fe + 2O2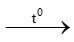 Fe3O4 (1)
Fe3O4 (1)
0,3 mol → 0,2mol → 0,1 mol
Từ (1) ta có số mol Fe3O4 = 0,1mol
→ m Fe3O4 = n.M = 0,1.232 = 23,2gam
b/ Từ (1) ta có số mol O2 đã dùng nO2 = 0,2 mol
Thể tích khí oxi đã dùng ở đktc: VO2 = n.22,4 = 0,2.22,4 = 4,48 lít
Thể tích không khí đã dùng: Vkk = 5. VO2= 5.4,48 = 22,4 lít.
c/ PTPƯ
2 KMnO4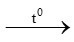 K2MnO4 + MnO2 + O2 (2)
K2MnO4 + MnO2 + O2 (2)
0,4444mol ← 0,222mol
Vì lượng Oxi thu được hao hụt 10% nên số mol O2 cần có là:
nO2 = 0,2mol.100/90 = 0.222 mol
Từ (2) ta có số mol KMnO4 = 0,444mol
Khối lượng KMnO4 bị nhiệt phân
mKMnO4 = n.M = 0,444.158 = 70.152 gam

\(n_{O_2}=\dfrac{8}{32}=0.25\left(mol\right)\)
\(CH_4+2O_2\underrightarrow{t^0}CO_2+2H_2O\)
\(0.125....0.25....0.125\)
\(m_{CH_4}=0.125\cdot16=2\left(g\right)\)
\(V_{CO_2}=0.125\cdot22.4=2.8\left(l\right)\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
\(............0.125.....0.125\)
\(m_{CaCO_3}=0.125\cdot100=12.5\left(g\right)\)

Sửa đề: 13,4 (l) → 13,44 (l)
Ta có: \(n_{CH_4}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
_____0,6___1,2___0,6 (mol)
a, \(V_{O_2}=1,2.22,4=26,88\left(l\right)\)
b, \(V_{CO_2}=0,6.22,4=13,44\left(l\right)\)
c, \(V_{kk}=5V_{O_2}=134,4\left(l\right)\)
`CH_4+2O_2->CO_2+2H_2O`to
`n_(CH_4)=(16,8)/(22,4)=0,75 mol`
`->V_(O_2)=1,5.22,4=33,6l`
`->m_(CO_2)=0,75.44=33g`
`-m_(H_2O)=1,5.18=27g`
#YBTr