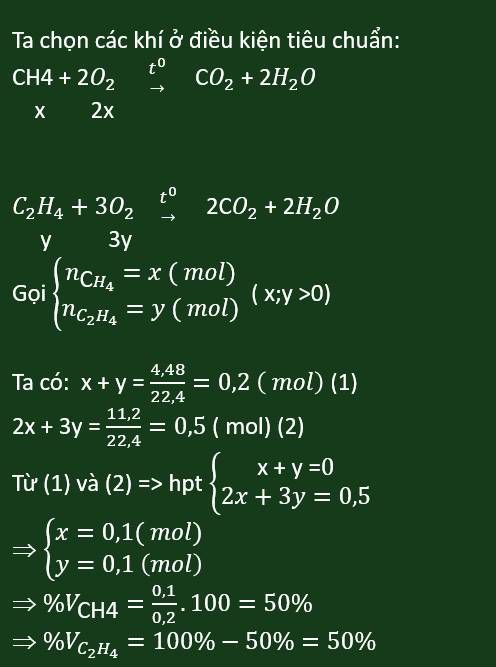Đốt cháy 4,48 lít benzen hỗn hợp khí gồm etan etilen, cần dùng 14,56 lít o2. Các khí đo ở điều kiện tiêu chuẩn a. viết phương trình xảy ra b. tính phần trăm thể tích mỗi khí trong hỗn hợp trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


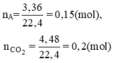
Gọi số mol của metan và etan lần lượt là x và y (mol)
Phương trình phản ứng:
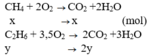
Vậy thành phần phần trăm về thể tích các khí trong hỗn hợp A là:
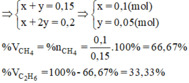

a, \(CH_4+2O_2\underrightarrow{^{t^o}}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{^{t^o}}2CO_2+2H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{15,68}{22,4}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=-0,1\\y=0,3\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.

a. Phương trình phản ứng :
C2H2 + 2Br2 → C2H2Br4 (1)
C2H4 + Br2 → C2H4Br2 (2)
b. Hỗn hợp khí B gồm có H2, C2H6. Gọi x, y ( mol ) lần lượt là số mol của H2 và C2H6 có trong 6,72 lít hỗn hợp B.
nB = x + y = 6,72 : 22,4 = 0,3 mol (I)
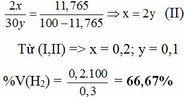
% V(C2H6) = 100% – 66,67% = 33,33%
c. nA = 11,2 : 22,4 = 0,5 mol , M A = 0,4 . 44 = 17,6 g/ mol
mA = 0,5 . 17,6 = 8,8 gam
mB = 0,2 . 2 + 0,1 . 30 = 3,4 gam
Vậy khối lượng bình Br2 tăng: m = mA – mB = 8,8 – 3,4 = 5,4 gam.

Chọn đáp án B
Khí thoát ra là N 2 không phản ứng.
% V c l o = 4 , 48 - 1 , 12 4 , 48 . 100 % =75%

PT: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}+\dfrac{5}{2}n_{C_2H_2}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow n_{C_2H_4}=n_{C_2H_2}=0,1\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\%V_{C_2H_2}=\dfrac{0,1.22,4}{4,48}.100\%=50\%\)

a) PTHH: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
b) Đặt \(n_{CH_4}=x\left(mol\right);n_{C_2H_4}=y\left(mol\right)\). Khi đó \(22,4x+22,4y=4,48\) \(\Leftrightarrow x+y=0,2\)
Từ PTHH \(\Rightarrow n_{O_2\left(1\right)}=2x\left(mol\right)\)\(;n_{O_2\left(2\right)}=3y\left(mol\right)\). Khi đó \(2x.22,4+3y.22,4=11,2\) \(\Leftrightarrow2x+3y=0,5\)
Vậy ta có \(\left\{{}\begin{matrix}x+y=0,2\\2x+3y=0,5\end{matrix}\right.\Leftrightarrow x=y=0,1\left(mol\right)\)
\(\Rightarrow\%V_{CH_4}=\%V_{C_2H_4}=50\%\)