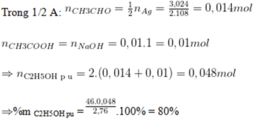Hòa tan 46,4 gam một oxit kim loại trong dung dịch chứa 88,2 gam axit sunfuric thu được dung dịch A. Để tác dụng hết với lượng axit còn dư trong A cần dùng dung dịch chứa 8 gam NaOH. Tìm công thức hóa học của oxit kim loại
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Khi hòa tan hỗn hợp vào dung dịch NaOH dư thì chỉ có Al và A12O3 bị hòa tan.
Khi đó 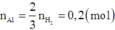
Khi hòa tan hỗn hợp vào dung dịch HCl (dư) thì cả ba chất trong hỗn hợp đều tan.
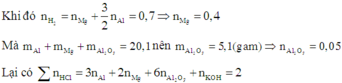
=> V = 2 (lít)

\(KL:A\left(II\right)\\ n_{H_2SO_4}=0,15.0,5=0,075\left(mol\right)\\n_{NaOH}=0,03.1=0,03\left(mol\right)\\ 2NaOH+H_2SO_4\rightarrow Na_2SO_4 +2H_2O\left(1\right)\\ A+H_2SO_4\rightarrow ASO_4+H_2\left(2\right)\\n_{H_2SO_4\left(1\right)}=\dfrac{0,03}{2}=0,015\left(mol\right)\\ n_{H_2SO_4\left(2\right)}=0,075-0,015=0,06\left(mol\right)=n_A\\ \Rightarrow M_A=\dfrac{1,44}{0,06}=24\left(\dfrac{g}{mol}\right)\\ \Rightarrow A:Magie\left(Mg=24\right)\\ \Rightarrow C\)


BTKL: mD + mNaHCO3 = mCO2 + mE
mD + 179,88 = 44.0,2 + 492 => mD = 320,92
BTKL: mMg + mddHCl = mH2 + mD
=> 24 . 0,4 + mddHCl = 2 . 0,4 + 320,92 => mddHCl = 312,12
=> C%HCl = 11,69%

\(n_{NaOH} = 0,15.2 = 0,3(mol)\\ 2NaOH + H_2SO_4 \to Na_2SO_4 + 2H_2O\\ n_{H_2SO_4\ dư} = \dfrac{1}{2}n_{NaOH} = 0,15(mol)\\ n_{H_2SO_4\ pư} = 0,75 - 0,15 = 0,6(mol)\\ \)
Gọi kim loại cần tìm là R
\(R + H_2SO_4 \to RSO_4 + H_2\\ n_R = n_{H_2SO_4} = 0,6(mol)\\ \Rightarrow M_R = \dfrac{24}{0,6} =40(Ca)\)
Vậy kim loại cần tìm là Canxi

a)
Gọi hóa trị hai kim loại là n
$4A + nO_2 \xrightarrow{t^o} 2A_2O_n$
$4B + nO_2 \xrightarrow{t^o} 2A_2O_n$
$A_2O_n + 2nHCl \to 2ACl_n + nH_2O$
$B_2O_n + 2nHCl \to 2BCl_n + nH_2O$
$ACl_n + nNaOH \to A(OH)_n + nNaCl$
$BCl_n + nNaOH \to B(OH)_n + nNaCl$
b)
Theo PTHH :
$n_{OH} = n_{NaOH} = n_{NaCl} = n_{HCl} = 0,15(mol)$
$m_{kết\ tủa} = m_{kim\ loại} + m_{OH} = 8 + 0,15.17 = 10,55(gam)$

bài 1
\(n_{MgO}=\dfrac{m}{M}=\dfrac{8}{40}=0,2\left(mol\right)\)
\(m_{H_2SO_4}=\dfrac{C\%.m_{dd}}{100}=\dfrac{10.147}{100}=14,7\left(g\right)\)
\(n_{H_2SO_4}=\dfrac{m}{M}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
PTHH:\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
TPƯ: 0,2 0,15
PƯ: 0,15 0,15 0,15 0,15
SPƯ: 0,05 0 0,15 0,15
a) \(m_{MgSO_4}=n.M=0,15.120=18\left(g\right)\)
b) theo định luật bảo toàn khối lượng
\(m_{ddspu}=m_{MgO}+m_{ddH_2SO_4}\)=8+147=155(g)
\(C\%_{MgO}=\dfrac{m_{ct}}{m_{dd}}.100=\dfrac{8}{155}.100=5,2\%\)
\(C\%_{MgSO_4}=\dfrac{18}{155}.100=11,6\%\)