Chia 10 gam hỗn hợp gồm 2 kim loại A và B có hóa trị không đổi thành 2 phần bằng nhau. Phần 1 đốt cháy hoàn toàn V lít khí O2 và thu được 5,32 gam hỗn hợp gồm 2 ôxít. Phần còn lại hòa tan trong dung dịch HCl dư thu được V' lít khí H2 thoát ra và m gam muối clorua. Tính V, V' và m. Biết các khí đo ở điều kiện tiêu chuẩn.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là 3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Qúa trình nhường electron:
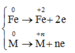
Quá trình nhận electron:
![]()
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường electron
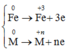
Quá trình nhận electron:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
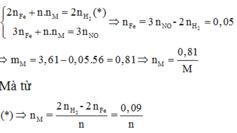
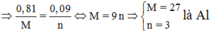

Đáp án D
Gọi n là hóa trị của M. Khối lượng hỗn hợp ở mỗi phần là nH2=3,61 gam, và nNO=0,08.
* Quá hình nhường và nhận electron khi hòa tan phần 1 vào dung dịch HCl dư:
Quá trình nhường e:
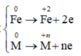
Quá trình nhận e:
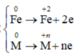
* Quá trình nhường và nhận electron khi hòa tan phần 2 vào dung dịch HNO3:
Quá trình nhường e:
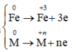
Quá trình nhận e:
![]()
Áp dụng định luật bảo toàn mol electron, ta có:
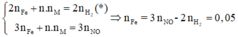
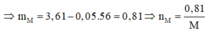
Mà từ
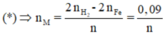
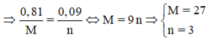
Là Al

Phản ứng nhiệt nhôm:
2 A l + F e 2 O 3 → t 0 A l 2 O 3 + 2 F e ( 1 )
Phần 1 tác dụng với dung dịch NaOH dư không sinh ra khí → hỗn hợp B không có Al dư. Vậy hỗn hợp B gồm A l 2 O 3 , Fe và có thể có F e 2 O 3 dư.
4,4 gam chất rắn không tan có thể gồm Fe và F e 2 O 3 d ư
Phần 2: tác dụng với H 2 S O 4 loãng dư → chỉ có Fe phản ứng sinh ra khí
n H 2 = 1,12 22,4 = 0,05
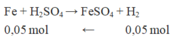
Khối lượng F e 2 O 3 dư ở phần 2 = 4,4 – mFe = 4,4 – 0,05.56 = 1,6 gam.
n F e 2 O 3 p u b d đ = 2. 1 2 . n F e ( p 2 ) = 0,05 m o l
Khối lượng F e 2 O 3 ban đầu: 0,05.160 + 1,6.2 = 11,2 gam.
⇒ Chọn B.

Chọn đáp án A
Vì hóa trị các kim loại không đổi nên số mol e nhường nhận trong hai thí nghiệm như nhau
Và bte-> mol e=0,15.2=0,3=>mol No=0,1=>V=2,24l

Đáp án A
Vì hai kim loại X, Y đều có hóa trị không đổi và khối lượng hai phần bằng nhau nên ở hai phần, số mol electron mà kim loại nhường bằng nhau.
Khi đó
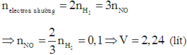

Gọi hóa trị của R là n và số mol Sn và R lần lượt là a và b mol
+/ Khi phản ứng với HCl :
Sn + HCl → SnCl2 + H2
R + nHCl → RCln + 0,5nH2
+/ Khi đốt trong oxi :
Sn + O2 → SnO2
2R + 0,5nO2 → R2On
=> Ta có : nH2 = a + 0,5nb = 0,225 mol
Và nO2 = a + 0,25nb = 0,165 mol
=> a = 0,105 mol ; nb = 0,24 mol
Có mmuối = 0,105.190 + 0,24/n . (R + 35,5n) = 36,27
=>R = 32,5n
=>Cặp n =2 ; R =65 (Zn) thỏa mãn
=>B