Đốt 24 ml hỗn hợp gồm C2H2 và CH4 phải dùng 54 ml khí oxygen (các thể tích khí đo ở đktc ). a. Xác định % thể tích của mỗi khí trong hỗn hợp. b. Tìm thể tích khí Carbon dioxide sinh ra (ở đktc)?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, $CH_4+2O_2\rightarrow CO_2+2H_2O$
$2C_2H_2+5O_2\rightarrow 4CO_2+2H_2O$
b, Gọi thể tích CH4 và C2H2 lần lượt là a;b
Ta có: $a+b=14;2a+2,5b=33,6\Rightarrow a=2,8;b=11,2$
$\Rightarrow \%V_{CH_4}=20\%;\%V_{C_2H_2}=80\%$
c, $CO_2+Ca(OH)_2\rightarrow CaCO_3+H_2O$
Ta có: $n_{CaCO_3}=n_{CO_2}=\frac{25,2.10^{-3}}{22,4}=1,125.10^{-3}$
$\Rightarrow m=0,11259(g)$

Đốt cháy hoàn toàn 28 lít hỗn hợp gồm CH4 và C2H2 trong đó CH4 chiếm 20% về thể tích. Hãy tính
a) Thể tích không khí cần dùng biết oxi chiếm 20% thể tích không khí
b) Thể tích khí CO2 tạo thành biết các khí đều đo ở đktc
-----------------------------
CH4 chiếm 20% trong 28 lit hỗn hợp
=> V CH4 = 20%.28 = 5,6 lit
=> nCH4 = V/22,4 = 0,25 mol
=> V C2H2 = 28 - 5,6 = 22,4 lit
=> n C2H2 = V/22,4 = 1 mol
CH4 + 2O2 ---------> CO2 + 2H2O
0,25 0,5 0,25
C2H2 + 5/2O2 -------------> 2CO2 + H2O
1 2,5 2
=> V kh + 2,5).100/20.22,4 = 336 lit
=> VCO2 = (0,25 + 2).22,4 = 50,4 lit

a) \(n_{CH_4}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,05-->0,1------->0,05
2C2H2 + 5O2 --to--> 4CO2 + 2H2O
0,125<--0,3125<----0,25
=> \(\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,05}{0,05+0,125}.100\%=28,57\%\\\%V_{C_2H_2}=\dfrac{0,125}{0,05+0,125}.100\%=71,43\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,05.16}{0,05.16+0,125.26}.100\%=19,753\%\\\%m_{C_2H_2}=\dfrac{0,125.26}{0,05.16+0,125.26}.100\%=80,247\%\end{matrix}\right.\)
b) \(n_{O_2}=0,1+0,3125=0,4125\left(mol\right)\)
=> \(V_{O_2}=0,4125.22,4=9,24\left(l\right)\)
=> Vkk = 9,24.5 = 46,2 (l)

a, \(CH_4+2O_2\underrightarrow{t^o}CO_2+H_2O\)
\(2C_2H_2+5O_2\underrightarrow{t^o}4CO_2+2H_2O\)
Ta có: \(n_{CH_4}+n_{C_2H_2}=\dfrac{33,6}{22,4}=1,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{CO_2}=n_{CH_4}+2n_{C_2H_2}=\dfrac{56}{22,4}=2,5\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,5\left(mol\right)\\n_{C_2H_2}=1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,5.22,4}{33,6}.100\%\approx33,33\%\\\%V_{C_2H_2}\approx66,67\%\end{matrix}\right.\)
b, Theo PT: \(n_{O_2}=2n_{CH_4}+\dfrac{5}{2}n_{C_2H_2}=3,5\left(mol\right)\Rightarrow m_{O_2}=3,5.32=112\left(g\right)\)

Bài 4. Đốt cháy 28 ml hỗn hợp khí metan và axetilen cần phải dùng 67,2 ml khí oxi.
a) Tính phần trăm thể tích của mỗi khí trong hỗn hợp.
b) Tính thể tích khí CO2 sinh ra.
(Các thể tích khí đo ở cùng điểu kiện nhiệt độ và áp suất).
Lời giải:
Đối với chất khí, trong cùng điều kiện về nhiệt độ và áp suất, tỉ lệ số mol trong phương trình phản ứng cũng là tỉ lệ về thể tích các khí.
a) Gọi thế tích của CH4 và C2H2 lần lượt là x, у (ml).
Phương trình phản ứng: CH4 + 2O2 → CO2 + 2H2O
p.ư: x -> 2x x (ml)
2C2H2 + 5O2 → 4CO2 + 2H2O
p.ư: у -> 2,5y 2y (ml)
Theo thể tích hỗn hợp và thể tích oxi, ta có hệ phương trình:
Giải (1) và (2), ta được x = 5,6ml và y = 22,4ml.
% =
x 100% = 20%; %
= 100% - 20% = 80%
b) Thể tích khí khí C02 sinh ra = x + 2y = 5,6 + 2 x 22,4 = 50,4ml.

a, PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(n_{CH_4}+n_{H_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\left(1\right)\)
Theo PT: \(n_{H_2O}=2n_{CH_4}+n_{H_2}=\dfrac{16,2}{18}=0,9\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{CH_4}=0,4\left(mol\right)\\n_{H_2}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{0,4.22,4}{11,2}.100\%=80\%\\\%V_{H_2}=20\%\end{matrix}\right.\)
b, Theo PT: \(n_{CO_2}=n_{CH_4}=0,4\left(mol\right)\Rightarrow V_{CO_2}=0,4.22,4=8,96\left(l\right)\)

PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{30,9875}{24,79}=1,25\left(mol\right)\)
a, \(n_{H_2O}=2n_{CH_4}=2,5\left(mol\right)\) \(\Rightarrow m_{H_2O}=2,5.18=45\left(g\right)\)
b, \(n_{O_2}=2n_{CH_4}=2,5\left(mol\right)\) \(\Rightarrow V_{O_2}=2,5.24,79=61,975\left(l\right)\)
Mà: O2 chiếm 1/5 thể tích không khí.
\(\Rightarrow V_{kk}=5V_{O_2}=309,875\left(l\right)\)

Đáp án B
0,2 mol hh khí gồm CH4 và C2H2 qua dd brom dư thấy nhạt màu và có 0,1 mol khí thoát ra.
• Khí thoát ra là CH4 → nCH4 = 0,1 mol
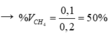
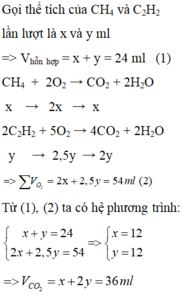
\(2C_2H_2\left(x\right)+5O_2\left(2,5x\right)\rightarrow4CO_2\left(2x\right)+2H_2O\)
\(CH_4\left(y\right)+2O_2\left(2y\right)\rightarrow CO_2\left(y\right)+2H_2O\)
Ta có : \(x+y=24\Rightarrow y=24-x\)
\(2,5x+2y=54\)
\(\Rightarrow2,5x+2\left(24-x\right)=54\)
\(\Rightarrow x=12ml\)
\(\Rightarrow y=12ml\)
a) \(\%C_2H_2=12.100\%:24=50\%\)
\(\%CH_4=100\%-50\%=50\%\)
b)\(V_{CO_2}=2x+y=36\left(ml\right)\)