Cho 11,36(g) hỗn hợp Fe, FeO, Fe2O3, Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, sau phản ứng thu được 1,4874 lít NO và dung dịch X. Tính khối lượng muối có trong X.
Mong mọi người giải chi tiết. Cảm ơn!!!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Quy đổi hỗn hợp thành hỗn hợp Fe (a mol) và O (b mol) =>56a + 16b = 11,36
Bảo toàn electron
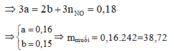
Đáp án D

Coi như hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 gồm có x mol Fe và y mol O
Ta có 56x+16y= 11,36 (1)
Ta có nNO= 0,06 mol
QT cho e :
Fe → Fe3++ 3e
x 3x mol
QT nhận e :
O+ 2e→ O-2
y 2y mol
N+5+ 3e → NO
0,18←0,06
Theo ĐL BT electron thì : ne cho= ne nhận nên 3x= 2y+ 0,18 (2)
Từ (1) và (2) ta có x= 0,16 và y= 0,15
Bảo toàn nguyên tố Fe có nFe(NO3)3= nFe= x= 0,16 mol→ mFe(NO3)3=38,72 gam
Đáp án D
Coi hh gồm Fe và O.
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_O=y\left(mol\right)\end{matrix}\right.\)
Ta có: 56x + 16y = 11,36 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Các quá trình:
\(Fe^0\rightarrow Fe^{+3}+3e\)
x_____________3x (mol)
\(O^0+2e\rightarrow O^{-2}\)
y_____2y (mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
______0,18___0,06 (mol)
BT e, có: n e nhường = n e nhận ⇒ 3x = 2y + 0,18 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,16\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
X chứa muối Fe(NO3)3.
BTNT Fe, có: nFe(NO3)3 = nFe = 0,16 (mol)
⇒ mFe(NO3)3 = 0,16.242 = 38,72 (g)