Để đốt 1kg than (90% C) cần V lít khí ở đk 25°C ,1 bar biết không khí chứa 20% là O2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 19:Dùng hết 5kg than (chứa 90% cacbon, 10% tạp chất không cháy) để đun nấu. Thể tích của không khí (ở đktc) đã dùng để đốt cháy lượng than trên là:
A. 4000 lít. B. 42000 lít. C. 4250 lít. D. 4500 lít.
Câu 20: Các chất cho trong dãy đều là oxit :
A. SO2 , CaO, N2O5 , H3PO4, SO3 B.NaOH,HCl,P2O5,SO3,Al2O3
C. SO2 , MgO , P2O5 , K2O , ZnO D.Al2O3,CO2,ZnO,CaCO3,K2O
Câu 21: Trong phòng thí nghiệm cần điều chế 4,48lít O2 (đktc)
Dùng chất nào sau đây để có khối lượng nhỏ nhất :
A. KClO3 B. KMnO4 C. KNO3 D. H2O(điện phân)
Câu 22: Nguyên liệu để sản xuất khí O2 trong công nghiệp là phương án nào sau đây:
A. KMnO4 B. KClO3 C. KNO3 D. Không khí
Câu 23: Chọn định nghĩa phản ứng phân huỷ đầy đủ nhất:
A. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra một chất mới
B. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai chất mới
C. Phản ứng phân huỷ là phản ứng hoá học trong đó một chất sinh ra hai hay nhiều chất mới
D. Phản ứng phân huỷ là phản ứng hoá học có chất khí thoát ra
Câu 24:Một Oxit của lưu huỳnh, trong đó lưu huỳnh chiếm 40% về khối lượng. Oxit đó là:
A. SO2 B. SO C. SO3 D.
Câu 25:Để oxi hóa hoàn toàn một kim loại M hóa trị II thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Kim loại M là:
A. Zn. b.Mg C. Ca. D. Ba.

Đổi 1kg = 1000g
mC = 1000 . (100% - 10%) = 900 (g)
nC = 900/12 = 75 (mol)
PTHH: C + O2 -> (t°) CO2
Mol: 75 ---> 75
VO2 = 75 . 22,4 . 5 = 8400 (l)

Ta có: \(m_C=1,5.1000.90\%=1350\left(g\right)\)
\(n_C=\dfrac{1350}{12}=112,5\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
Theo PT: \(n_{O_2}=n_C=112,5\left(mol\right)\)
\(\Rightarrow V_{O_2}=112,5.22,4=2520\left(l\right)\)
\(V_{kk}=V_{O_2}.5=12600\left(l\right)\)

\(n_C=\dfrac{3.6}{12}=0.3mol\)
\(C+O_2\underrightarrow{t^o}CO_2\)
0.3 0.3
\(V_{O_2}=0.3\times22.4=6.72l\)
\(V_{Kk}=6.72\times5=33.6l\)

a) Giả sử các khí được đo ở điều kiện sao cho 1 mol khí chiếm thể tích 1 lít
Gọi số mol hỗn hợp khí là a (mol) => \(\left\{{}\begin{matrix}n_{CH_4}=0,9a\left(mol\right)\\n_{C_2H_4}=0,05a\left(mol\right)\\n_{C_3H_8}=0,05a\left(mol\right)\end{matrix}\right.\)
\(n_{O_2}=\dfrac{246,4.20\%}{1}=49,28\left(mol\right)\)
=> \(n_{N_2}=\dfrac{246,4}{1}-49,28=197,12\left(mol\right)\)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,9a->1,8a---->0,9a--->1,8a
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05a->0,15a------>0,1a-->0,1a
C3H8 + 5O2 --to--> 3CO2 + 4H2O
0,05a-->0,25a----->0,15a-->0,2a
=> 1,8a + 0,15a + 0,25a = 49,28
=> a = 22,4 (mol) => V = 22,4.1 = 22,4 (l)
b) Sau phản ứng thu được \(\left\{{}\begin{matrix}N_2:197,12\left(mol\right)\\CO_2:25,76\left(mol\right)\\H_2O:47,04\left(mol\right)\end{matrix}\right.\)
- Nếu H2O ở thể lỏng
=> hh khí gồm N2, CO2
=> \(V_{hh}=\left(197,12+25,76\right).1=222,88\left(l\right)\)
- Nếu H2O ở thể khí
=> hh gồm N2, CO2, H2O
=> \(V_{hh}=\left(197,12+25,76+47,04\right).1=269,92\left(l\right)\)

Cnguyên chất = (100%-10%).1000 = 900 (g)
\(n_C=\dfrac{900}{12}=75\left(mol\right)\)
PTHH: C + O2 ---to→ CO2
Mol: 75 75
\(V_{O_2}=75.22,4=1680\left(l\right)\)
\(m_{CO_2}=75.44=3300\left(g\right)\)
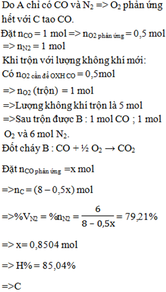
Ta có: mC = 1.1000.90% = 900 (g)
\(\Rightarrow n_C=\dfrac{900}{12}=75\left(mol\right)\)
PT: \(C+O_2\underrightarrow{t^o}CO_2\)
\(n_{O_2}=n_C=75\left(mol\right)\Rightarrow V_{O_2}=75.24,79=1859,25\left(l\right)\)
\(\Rightarrow V_{kk}=\dfrac{V_{O_2}}{20\%}=9296,25\left(l\right)\)