Hòa tan hỗn hợp gồm 2 kim loại kiềm kế tiếp nhau vào nước được dung dịch x và 3,7285 lít khí h2 ở điều kiện chuẩn cho HCl dư vào dung dịch x và cô cạn thu được 2,075 g muối khan a) tìm tên hai kim loại kiềm b) tính khối lượng của mỗi kim loại kiềm trong hỗn hợp ban đầu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, Ta có: \(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Giả sử 2 KL cần tìm là A.
PT: \(A+2HCl\rightarrow ACl_2+H_2\)
Theo PT: \(n_A=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow M_A=\dfrac{4,4}{0,15}=29,33\left(g/mol\right)\)
Mà: 2 KL nằm ở 2 chu kì kế tiếp.
→ Mg và Ca.
b, Ta có: 24nMg + 40nCa = 4,4 (1)
BT e, có: 2nMg + 2Ca = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Mg}=0,1\left(mol\right)\\n_{Ca}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,1.24=2,4\left(g\right)\\m_{Ca}=0,05.40=2\left(g\right)\end{matrix}\right.\)

Coi hai nguyên tố là R \(\Rightarrow\overline{M}=M_R\)
a, PTHH:
\(2R+2H_2O\rightarrow2ROH+H_2\uparrow\)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\Rightarrow n_R=2n_{H_2}=0,3\left(mol\right)\)
Khi đó \(\overline{M}=M_R=\dfrac{9,3}{0,3}=31\left(g/mol\right)\)
\(\Rightarrow\) Hai nguyên tố lần lượt là Na, K
b, PTHH:
\(2ROH+H_2SO_4\rightarrow R_2SO_4+2H_2O\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{1}{2}n_{ROH}=n_{H_2}=0,15\left(mol\right)\)
\(\Rightarrow V_{ddH_2SO_4}=\dfrac{n_{H_2SO_4}}{C_M}=\dfrac{0,15}{2}=0,075\left(l\right)\)
\(n_{R_2SO_4}=n_{H_2SO_4}=0,15\left(mol\right)\)
\(\Rightarrow m_{R_2SO_4}=0,15.\left(31.2+32+16.4\right)=23,7\left(g\right)\)

Đáp án: A
Ta có: nHCl= 2nH2 = 0,5 mol
m muối = m kim loại + mCl-
= 8,4 + 0,5. 35,5 = 26,15 gam
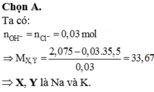
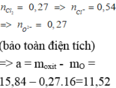
a) Sửa đề: `3,7285 -> 3,7185` và `2,075 -> 20,75`
\(n_{H_2}=\dfrac{3,7185}{24,79}=0,15\left(mol\right)\)
Đặt CT chung của 2 kim loại kiềm là R
\(2R+2H_2O\rightarrow2ROH+H_2\)
0,3<-------------0,3<-----0,15
\(ROH+HCl\rightarrow RCl+H_2O\)
0,3------------->0,3
\(\Rightarrow M_{RCl}=\dfrac{20,75}{0,3}=\dfrac{415}{6}\left(g/mol\right)\\ \Rightarrow M_R=\dfrac{415}{6}-35,5=\dfrac{101}{3}\left(g/mol\right)\)
`=>` 2 kim loại là Na và K
b) Đặt \(\left\{{}\begin{matrix}n_{Na}=a\left(mol\right)\\n_K=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}a+b=0,3\\58,5+74,5=20,75\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Na}=0,1.23=2,3\left(g\right)\\m_K=0,2.39=7,8\left(g\right)\end{matrix}\right.\)