Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn B
Kim loại hóa trị II Þ nM = nH2 = 0,6 Þ MM = 14,4/0,6 = 24 (Mg).

\(n_{Fe} = a(mol) ; n_M = b(mol)\\ \Rightarrow 56a + Mb = 12\)
\(Fe + 2HCl \to FeCl_2 + H_2\\ M + 2HCl \to MCl_2 + H_2\\ n_{H_2} = a + b = \dfrac{4,48}{22,4} = 0,2(mol)\\ \Rightarrow a = 0,2 - b ( 0< b < 0,2)\)
Suy ra:
56(0,2 - b) + Mb = 12
\(\Rightarrow M = \dfrac{0,8 + 56b}{b}\)
Vì 0 < b < 0,12
Nên M > 62,67(1)
Mặt khác,
\(n_M > \dfrac{1}{2}n_{HCl} = 0,35\\ \Rightarrow M < \dfrac{23,8}{0,35} = 68(2)\)
Từ (1)(2) suy ra: 62,67 < M < 68
Do đó, M = 65(Zn) thì thỏa mãn
Vậy M là Zn(Kẽm)

2 khí không màu, không hóa nâu trong không khí và là sản phẩm khử của N+5 chỉ có thể là N2 và N2O
-TH1: 21,19 gam muối không có muối NH4NO3
Theo bảo toàn nguyên tố M ta có: nM= nM(NO3)2
→ m M m M ( N O 3 ) 2 = M M M M ( N O 3 ) 2 → 7 , 15 21 , 19 = M M + 62 , 2
→M= 63,148 Loại
Do đó trường hợp này loại
-TH2: 21,19 gam muối có muối NH4NO3
QT cho e:
M → M2++ ne (1)
7,15/M 7,15.2/M
QT nhận e : nkhí= 0,02 mol. Mà số mol hai khí bằng nhau nên n N 2 O = n N 2 =0,01mol
2NO3-+ 8e+ 10H+ → N2O + 5H2O (2)
0,08 0,1 ← 0,01 mol
2NO3-+ 10e+12H+→ N2+ 6H2O (3)
0,1 0,12← 0,01 mol
NO3-+ 8e + 10H+ → NH4+ + 3H2O (4)
8x xmol
Đặt số mol muối NH4+ là x mol
Theo ĐL BT e: ne cho= ne nhận nên 7,15.2/M= 0,08 + 0,1+8x (*1)
Mặt khác : mmuối= mM(NO3)2+ mNH4NO3= 7,15/M. (M+124)+80x= 21,19 (*2)
Từ (*1) và (*2) ta có: x= 5.10-3 và M=65. M là Zn
Đáp án D

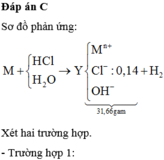

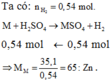
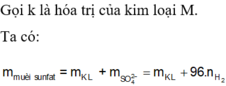
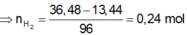
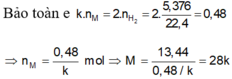
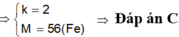



Gọi hóa trị của M là n.
Ta có: \(n_{H_2}=\dfrac{5,376}{22,4}=0,24\left(mol\right)\)
PT: \(2M+nH_2SO_4\rightarrow M_2\left(SO_4\right)_n+nH_2\)
Theo PT: \(n_M=\dfrac{2}{n}n_{H_2}=\dfrac{0,48}{n}\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{15,6}{\dfrac{0,48}{n}}=\dfrac{65}{2}n\left(g/mol\right)\)
Với n = 2 thì MM = 65 (g/mol)
Vậy: M là Zn.