Ngâm một lá đồng vào 340 gam dung dịch AgNO3 10%. Sau khi tất cả bạc bị đẩy ra khỏi dung dịch AgNO3 và bám hết vào lá đồng, thì khối lượng lá đồng tăng lên 38%. Xác định khối lượng lá đồng ban đầu.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: mCuSO4=(320x10):100=32g=>nCuSO4=32:160=0...
ptpu: Fe + CuSO4 => FeSO4 + Cu
0,2 0,2 mol 0,2 mol
Độ tăng khối lượng của miếng sắt là: 0,2x(64-56)=1,6g
Theo đề: độ tăng của miếng sắt là 8% nên
1,6g -------> 8%
20g <--------- 100%
Vậy khối lượng miếng sắt ban đầu là 20g
BẠN THAM KHẢO

Số mol CuSO 4 = 10/100 = 0,1 mol
Phương trình hóa học của phản ứng:
Fe + CuSO 4 → FeSO 4 + Cu
Khối lượng Fe phản ứng: 0,1 . 56 =5,6(gam)
Khối lượng Cu sinh ra: 0,1 . 64 = 6,4 (gam)
Gọi x là khối lượng lá sắt ban đầu
Khối lượng lá sắt khi nhúng vào dung dịch CuSO 4 tăng lên là: 4x/100 = 0,04x (gam)
Khối lượng lá sắt tăng lên = m Cu sinh ra - m Fe phản ứng = 0,04x = 6,4 -5,6 = 0,8
=> x= 20 gam

\(400ml=0,4l\)
\(n_{AgNO_3}=0,4.0,1=0,04mol\)
\(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
\(\rightarrow n_{Zn}=0,02mol\) và \(n_{Ag}=0,04mol\)
\(\rightarrow m_{rm\text{kim loại tăng}}=0,04.108-65.0,02=3,02g\)
\(\rightarrow m_{Zn\left(bđ\right)}=\frac{3,02}{4\%}=75,5g\)

Cu → 2Ag
1 2 → mtang = 2.108-64 = 152g
x 2x → mtang = =1,52g
⇒ x = 1,52/152 = 0,01 mol
⇒ n A g N O 3 = n A g = 2x = 0,02 mol
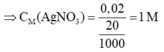
⇒ Chọn C.

PTHH: \(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
a) Ta có: \(n_{AgNO_3}=\dfrac{300\cdot5\%}{170}=\dfrac{3}{34}\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Ag}=\dfrac{3}{34}\left(mol\right)\\n_{Cu}=\dfrac{3}{68}\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{Ag}=\dfrac{3}{34}\cdot108\approx9,53\left(g\right)\\m_{Cu}=\dfrac{3}{68}\cdot64\approx2,82\left(g\right)\end{matrix}\right.\)
b) Coi như p/ứ vừa đủ
Theo PTHH: \(n_{Cu\left(NO_3\right)_2}=n_{Cu}=\dfrac{3}{68}\left(mol\right)\) \(\Rightarrow m_{Cu\left(NO_3\right)_2}=\dfrac{3}{68}\cdot188\approx8,29\left(g\right)\)
Mặt khác: \(m_{dd\left(sau.p/ứ\right)}=m_{Cu}+m_{ddAgNO_3}-m_{Ag}=293,29\left(g\right)\)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{8,29}{293,29}\cdot100\%\approx3,46\%\)

\(n_{AgNO_3}=\dfrac{300.5\%}{170}=\dfrac{3}{34}\left(mol\right)\)
\(Cu+2AgNO_3\rightarrow Cu\left(NO_3\right)_2+2Ag\)
Ta có : \(n_{Cu}=\dfrac{1}{2}n_{AgNO_3}=\dfrac{3}{68}\left(mol\right)\)
=> \(m_{Cu}=\dfrac{3}{68}.64=2,82\left(g\right)\)
\(n_{Ag}=n_{AgNO_3}=\dfrac{3}{34}\left(mol\right)\)
=>\(m_{Ag}=\dfrac{3}{34}.108=9,53\left(g\right)\)
\(m_{ddsaupu}=2,82+300-9,53=293,29\left(g\right)\)
Ta có : \(n_{Cu\left(NO_3\right)_2}=\dfrac{1}{2}n_{AgNO_3}=\dfrac{3}{68}\left(mol\right)\)
\(\Rightarrow C\%_{Cu\left(NO_3\right)_2}=\dfrac{\dfrac{3}{68}.188}{293,29}.100=2,83\%\)
