hoà tan 16g hỗn hợp mg và cu vào dung dịch HCl(dư), sau phản ứng thu được 2,24 lít khí(ở điều kiện tiêu chuẩn) và chất rắn b. lấy b cho tác dụng với h2so4( đặc) đun nóng sinh ra khí co2: a, viết phương trình hoá học xảy ra. b, tính khối lượng mỗi kim loại trong hỗn hợp a Giúp mình với ạ, mình cảm ơn nhiềuuu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Mg}=\dfrac{7,2}{24}=0,3\left(mol\right);n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(PTHH:2Mg+O_2-^{t^o}\rightarrow2MgO\) (1)
Theo đề : 0,3........0,1
Lập tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,1}{1}\) => Mg dư, O2 phản ứng hết
\(n_{Mg\left(pứ\right)}=2n_{O_2}=0,2\left(mol\right)\)
\(Mg_{dư}+2HCl\rightarrow MgCl_2+H_2\uparrow\)(2)
\(MgO+2HCl\rightarrow MgCl_2+H_2O\) (3)
Khí Y là H2
Theo PT (2) : \(n_{H_2}=n_{Mg\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
Dung dịch X là MgCl2
\(m_{ddsaupu}=0,1.24+0,2.40+75-0,1.2=85,2\left(g\right)\)
=>\(C\%_{MgCl_2}=\dfrac{\left(0,2+0,1\right).95}{85,2}.100=33,45\%\)

2) n Mg = \(\dfrac{7,2}{24}\) = 0,3 (mol)
n O2 = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Mg + 1/2O2 --to> MgO
0,2 <--- 0,1 --------> 0,2
n Mg dư = 0,3 - 0,2 = 0,1 (mol)
n MgO = 0,2 (mol)
MgO + 2HCl --> MgCl2 + H2O
0,2 ------> 0,4 (mol)
Mg + 2HCl --> MgCl2 + H2
0,1 --> 0,2 ------- --------> 0,1 (mol)
V H2 = 0,1 . 22,4 = 2,24 (lít)
m Ct=\(\dfrac{100.29,2\%}{100\%}\)=92,2g
m HCl = \(\dfrac{29,2}{36,5}\) = 0,8 (mol) > 0,6 (mol) Pứ hết cho ra MgCl2
m dd = m MgO + m Mg + m HCl dd - m H2
= 0,2.40 + 0,1.24 + 100 - 0,1.2 = 110,2 (g)
\(C\%=\dfrac{0,3.95}{110,2}.100\%=25,86\%\)
2) n Mg = \(\dfrac{7,2}{24}\) = 0,3 (mol)
n O2 = \(\dfrac{2,24}{22,4}\)= 0,1 (mol)
Mg + 1/2O2 --to> MgO
0,2 <--- 0,1 --------> 0,2
n Mg dư = 0,3 - 0,2 = 0,1 (mol)
n MgO = 0,2 (mol)
MgO + 2HCl --> MgCl2 + H2O
0,2 ------> 0,4 (mol)
Mg + 2HCl --> MgCl2 + H2
0,1 --> 0,2 ------- --------> 0,1 (mol)
V H2 = 0,1 . 22,4 = 2,24 (lít)
m Ct=\(\dfrac{100.29,2\%}{100\%}\)
m HCl = \(\dfrac{29,2}{36,5}\) = 0,8 (mol) > 0,6 (mol) Pứ hết cho ra MgCl2
m dd = m MgO + m Mg + m HCl dd - m H2
= 0,2.40 + 0,1.24 + 100 - 0,1.2 = 110,2 (g)
\(C\%=\dfrac{0,3.95}{110,2}.100\%=25,86\%\)

Đáp án D
Áp dụng bảo toàn electron có: ![]()
Trường hợp 1: Chất rắn chỉ có Ag
⇒ n Ag = 0 , 7 mol ⇒ m Ag = 75 , 6 gam > 45 , 2 => Loại
Trường hợp 2: Chất rắn có a mol Ag và 2a mol Cu
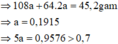
=> Loại =>Ag+ phản ứng hết, Cu2+ phản ứng còn dư
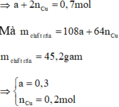

Vì Cu không tác dụng với HCl loãng :
\(n_{H2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Pt : \(Mg+2HCl\rightarrow MgCl_2+H_2|\)
1 2 1 1
0,1 0,1
\(n_{Mg}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
\(m_{Mg}=0,1.24=2,4\left(g\right)\)
⇒ \(m_{Cu}=10-2,4=7,6\left(g\right)\)
Chúc bạn học tốt

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

a, Mg + 2HCl \(\rightarrow\) MgCl2 + H2 Cu + 2HCl \(\rightarrow\) CuCl2 + H2
b, \(\left\{{}\begin{matrix}n_{Mg}=x\\n_{Cu}=y\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}24x+64y=16\\x+y=\dfrac{2,24}{22,4}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=-0,24\\y=0,34\end{matrix}\right.\)
Xem lại đầu bài nha