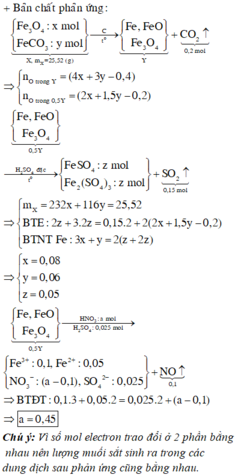
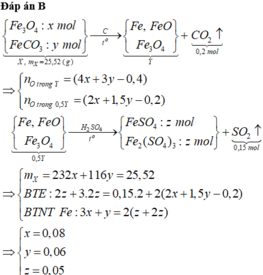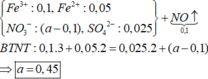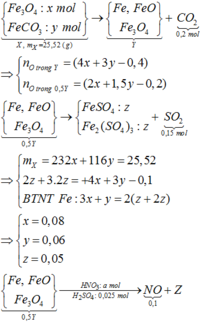GIÚP EM VỚI Ạ HUHU:((
chia m gam hỗn hợp X gồm Fe và FeO thành 2 phần bằng nhau
Phần 1: hòa tan hoàn toàn phần 1 trong h2so4 loãng dư thì thu đc 0,2 mol khí
Phần 2: hòa tan hết trong h2so4 đặc , dư thì thu được 0,35 mol khí So2 ( duy nhất )
a. tính giá trị m
b. tính số mol NaOH tối thiểu cần để hấp thụ hết lượng khí So2 trên
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(\text{a) Khối lượng phần 1 = Khối lượng phần 2 = 78.4/2=39.2}\)
Đặt công thức của oxit sắt là \(Fe_xO_y\)
Phần 1: \(CuO+CO\underrightarrow{t^0}Cu+CO_2\)
\(Fe_xO_y+yCO\underrightarrow{t^0}xFe+yCO_2\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(\Rightarrow m_{Cu}=12.8\Rightarrow n_{Cu}=n_{CuO}=0.2\Rightarrow m_{CuO\left(\text{1 phần}\right)}=0.2\times80=16\left(g\right)\)
\(\Rightarrow\%^mCuO=\dfrac{16}{39.2}\times100\approx40.81\%\Rightarrow\%^mFe_xO_y=51.9\%\)
b)
\(\text{Đặt số mol của Fe_xO_y là a( mol)}\)
\(CuO+2HCl\rightarrow CuCl_2+H_2\)
0.2 0.4
\(Fe_xO_y+2yHCl\rightarrow FeCl_{\dfrac{2y}{x}}+yH_2O\)
a 2ay
\(\Sigma^nHCl=\dfrac{43.8}{36.5}=1.2\left(mol\right)\)
=> 2ay+0.4=1.2=>ay=0.4 (1)
\(m_{Fe_xO_y\left(\text{1 phần}\right)}=39.2-16=23.2\Rightarrow n_{Fe_xO_y}=a=\dfrac{23.2}{56x+16y}\left(mol\right)\)
=>(56x+16y)a=23.2=>56ax+16ay=23.2 (2)
Từ (1) (2) => 56ax+16*0.4=23.2=>56ax=16.8=> ax=0.3 (3)
\(\text{Từ (1) (3)}\Rightarrow\dfrac{ax}{ay}=\dfrac{0.3}{0.4}\Rightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
Công thức oxit sắt là \(Fe_3O_4\)

\(m_{KL\left(mỗi.phần\right)}=\dfrac{1}{2}.15,6=7,8\left(g\right)\)
- Phần 1:
\(n_{SO_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH:
\(Zn+2H_2SO_{4\left(đ,nóng\right)}\rightarrow ZnSO_4+SO_2\uparrow+2H_2O\left(1\right)\\ Cu+2H_2SO_{4\left(đ,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\left(2\right)\\ 2Al+6H_2SO_{4\left(đ,nóng\right)}\rightarrow Al_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\left(3\right)\)
Theo PTHH (1,2, 3): \(n_{H_2O}=n_{H_2SO_4}=2n_{SO_2}=2.0,35=0,7\left(mol\right)\)
Áp dụng ĐLBTKL:
\(m_{KL}+m_{H_2SO_4}=m_{muối.sunfat}+m_{SO_2}+m_{H_2O}\)
=> mmuối sunfat = 7,8 + 0,7.98 - 0,35.64 - 0,7.18 = 41,4 (g)
\(\rightarrow m_{SO_4^{2-}}=41,4-7,8=33,6\left(g\right)\\ n_{SO_4^{2-}}=\dfrac{33,6}{96}=0,35\left(mol\right)\)
- Phần 2:
PTHH:
\(2Zn+O_2\underrightarrow{t^o}2ZnO\\ 2Cu+O_2\underrightarrow{t^o}2CuO\\ 4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
\(n_{O^{2-}}=n_{SO_4^{2-}}=0,35\left(mol\right)\\ \rightarrow m_{O^{2-}}=0,35.16=5,6\left(g\right)\\ \rightarrow m=5,6+7,8=13,4\left(g\right)\)

a, Ta có: $n_{O}=0,6(mol)$
Suy ra $n_{H^+/pu}=1,2(mol)\Rightarrow n_{H_2SO_4}=0,6(mol)$
Bảo toàn khối lượng ta có: $m_{muoi}=29,6+0,6.96=87,2(g)$

Đáp án A
Khối lượng hỗn hợp kim loại ở mỗi phần là 7,4 gam.
Phần 1: Khối lượng muối thu được lớn hơn khối lượng kim loại ban đầu là do các cation kim loại kết hợp với các gốc S O 4 2 - tạo thành muối.
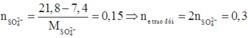
Số mol electron trao đổi ở hai phần bằng nhau.
Do đó ở phần 2: nAg = ne trao đổi = 0,3
=> mAg = 32,4 (gam)
Vậy m = 32,4 – 7,4 = 25 (gam)