Muối A có chứa Fe,S,O có thành phần % các nguyên tố : 36,8%Fe, 21%S, còn lại O.Tìm CTHH của A. Biết khối lượng mol của A là 152 g/mol
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


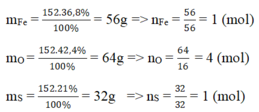
Vậy trong 1 phân tử hợp chất có 1 nguyên tử Fe, 4 nguyên tử O, 1 nguyên tử S.
⇒ CTHH là FeSO4.

Khối lượng mol của Fe là MFe = = 56 g
Khối lượng mol của S là: MS = = 32 g
Khối lượng mol của O là: MO = = 64 g
Gọi công thức hóa học của hợp chất là FeXSyOz, ta có:
56 . x = 56 => x = 1
32 . y = 32 => y = 1
16 . z = 64 => z = 4
Vậy hợp chât có công thức hóa học là FeSO4
Khối lượng mol của Fe là \(M_{Fe}\) = (152 . 36,8)/100 = 56 g
Khối lượng mol của S là: \(M_S\) = (152 . 21)/100 = 32 g
Khối lượng mol của O là: \(M_O\) = (152 . 42,2)/100 = 64 g
Gọi công thức hóa học của hợp chất là \(Fe_xS_yO_z\), ta có:
\(56.x=56\Rightarrow x=1\)
\(32.y=32\Rightarrow y=1\)
\(16.z=64\Rightarrow z=4\)
Vậy hợp chât có công thức hóa học là \(FeSO_4\)

Sửa đề:bài 1: Hãy tìm CTHH của một hợp chất có chứa 36,8% Fe;21% S và còn lại là O . Biết khối lượng mol của hợp chất là 152 g/mol
Gọi CTHH của HC là FexSyOz
x=\(\dfrac{152.36,8\%}{56}=1\)
y=\(\dfrac{152.16,5\%}{32}=1\)
z=\(\dfrac{152-56-32}{16}=4\)
Vậy CTHH của HC là FeSO4
Bài 2: Hãy tìm CTHH của một hợp chất có chứa27,1%Fe;16,5%N và còn lại là O . Biết khối lượng mol của hợp chất là 85 g/mol

\(m_{Fe}=\%Fe.M_X=28\%.400=112\left(g\right)\\ m_S=\%S.M_X=24\%.400=96\left(g\right)\\ m_O=m_X-m_{Fe}-m_S=400-112-96=192\left(g\right)\)
\(\Rightarrow n_{Fe}=\dfrac{m}{M}=\dfrac{112}{56}=2\left(mol\right)\)
\(m_S=\dfrac{m}{M}=\dfrac{96}{32}=3\left(mol\right)\)
\(m_O=\dfrac{m}{M}=\dfrac{192}{16}=12\left(mol\right)\)
\(CTHH:Fe_2\left(SO_4\right)_3\)

\(m_S=\dfrac{64.50}{100}=32\left(g\right)=>n_S=\dfrac{32}{32}=1\left(mol\right)\)
\(m_O=64-32=32\left(g\right)=>n_O=\dfrac{32}{16}=2\left(mol\right)\)
=> CTHH: SO2
Gọi CTHH là $Fe_xS_yO_z$
Ta có :
$\dfrac{56x}{36,8} = \dfrac{32y}{21} = \dfrac{16z}{100 - 36,8 - 21} = \dfrac{152}{100}$
Suy ra: x = 1 ; y = 1 ; z = 4
Suy ra CTHH của A là $FeSO_4$