Nung nóng 26,2 gam hỗn hợp kim loại gồm:Mg,Al,Zn trong không khí đến khi phản ứng xảy ra hoàn toàn thu được 40,6gam hỗn hợp 3 oxit. Để hòa tan hết lượng oxit trên cần V lít dung dịch HCl 0.5M a) Tính giá trị của V b)Tính khối lượng muối clorua tạo thành phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có sơ đồ chuyển hoá :
Mg, Zn, Al → O 2 MgO, ZnO, Al 2 O 3
MgO + 2HCl → MgCl 2 + H 2 O
ZnO + 2HCl → ZnCl 2 + H 2 O
Al 2 O 3 + 6HCl → 2 AlCl 3 + 3 H 2 O
MgO, ZnO, Al 2 O 3 → HCl MgCl 2 , ZnCl 2 , AlCl 3
Bảo toàn khối lượng: m oxit + m HCl = m muối + m H 2 O
⇒ 20,3 + 0,9.36,5 = m muối + 0,45.18
⇒ m muối = 45,05g

Ta có sơ đồ chuyển hoá :
Mg, Zn, Al → O 2 MgO, ZnO, Al 2 O 3
MgO + 2HCl → MgCl 2 + H 2 O
ZnO + 2HCl → ZnCl 2 + H 2 O
Al 2 O 3 + 6HCl → 2 AlCl 3 + 3 H 2 O
MgO, ZnO, Al 2 O 3 → HCl MgCl 2 , ZnCl 2 , AlCl 3
Ta có khối lượng O 2 đã phản ứng : m O 2 = 20,3 - 13,1 = 7,2 (g)
Vậy khối lượng oxi trong hỗn hợp oxit là 7,2 gam.
Toàn bộ lượng oxi trong oxit đã chuyển vào H 2 O nên ta có m O ( H 2 O ) = 7,2g
Cứ 1 mol H 2 O thì chứa 1 mol nguyên tử O ⇒ n H 2 O = n O = 7,2 : 16 = 0,45 mol
Từ phương trình ta có:
n HCl = 2 n H 2 O = 2.0,45 = 0,9 mol
⇒ V HCl = 0,9/0,4 = 2,25l

Chọn C
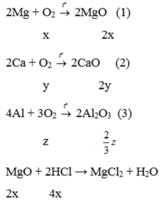

Áp dụng định luật bảo toàn khối lượng cho PT (1), (2), (3), ta có:
![]()
![]()

Dung dịch Ca(OH)2 không hấp thụ khí CO nên 6,72 lít khí thoát ra chính là khí CO dư.

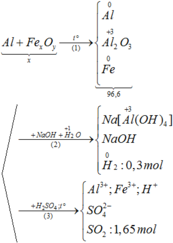
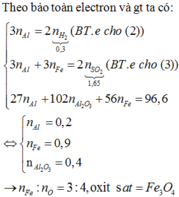

a)
$m_{O\ trong\ oxit} = 40,6 - 26,2 = 14,4(gam)$
$n_O = \dfrac{14,4}{16} =0,9(mol)$
$2H^+ + O^{2-} \to H_2O$
$n_{HCl} = n_{H^+} = 2n_O = 1,8(mol)$
$\Rightarrow V = \dfrac{1,8}{0,5} = 3,6(lít)$
b) $n_{Cl} = n_{HCl} = 1,8(mol)$
$m_{muối} = m_{kim\ loại} + m_{Cl} = 26,2 + 1,8.35,5 = 90,1(gam)$