Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 0,04 mol
nAg+ = 0,02 mol ; nCu2+ = 0,01 mol
Fe + 2Ag+ → Fe2+ + 2Ag
0,01 ← 0,02
Fe + Cu2+ → Fe2+ + Cu
0,03 0,1 → 0,03
Chất rắn sau phản ứng có : 0,02 mol Ag ; 0,03 mol Cu
=> m = 4,08g
Đáp án A

Chọn A
Vì: nFe = 0,04 mol
nAg+ = 0,02 mol ; nCu2+ = 0,01 mol
Fe + 2Ag+ → Fe2+ + 2Ag
0,01 ← 0,02
Fe + Cu2+ → Fe2+ + Cu
0,03 0,1 → 0,03
Chất rắn sau phản ứng có : 0,02 mol Ag ; 0,03 mol Cu
=> m = 4,08g

Đáp án C.
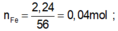
![]()
![]()
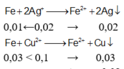
→ mrắn = mAg + mcu =0,02 . 108 + 0,03 . 64 = 4,08 (g)

Chọn đáp án B
Ta có sơ đồ:
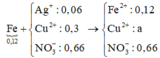
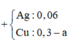
+ Rõ ràng AgNO3 đã phản ứng hết.
+ Ta có ∑nNO3– = 0,66 mol.
+ Bảo toàn điện tích ⇒ nCu2+ = (0,66 – 0,12x2) ÷ 2 = 0,21 mol.
⇒ nCu bị đẩy ra = 0,3 – 0,21 = 0,09 mol || nAg = 0,06 mol
⇒ mY = mCu + mAg = 0,06×108 + 0,09×64 = 12,24 gam
⇒ Chọn B

Đáp án D
![]()
![]()
![]()
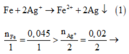
Sau phản ứng (1) Fe còn dư
→ n Fe dư = 0,045 ─ 0,01 = 0,035 mol
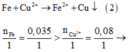
Sau phản ứng (2) C u 2 + còn dư
→ Chất rắn gồm Ag và Cu
→ m chất rắn = m A g + m C u = 0,02.108 + 0,035.64 = 4,4 g
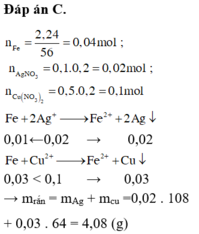

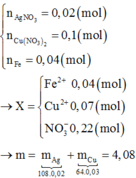

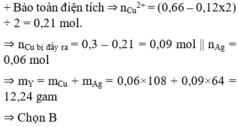


a) Ta có: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right)\\n_{AgNO_3}=0,2.0,1=0,02\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,2.0,5=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: \(Fe+2AgNO_3\rightarrow Fe\left(NO_3\right)_2+2Ag\downarrow\) (1)
ban đầu 0,4 0,02
sau pư 0,39 0 0,01 0,02
\(Fe+Cu\left(NO_3\right)_2\rightarrow Fe\left(NO_3\right)_2+Cu\downarrow\) (2)
ban đầu 0,39 0,1
sau pư 0,29 0 0,1 0,1
=> mA = 0,1.64 + 0,02.108 + 0,29.56 = 24,8 (g)
b) \(C_{M\left(Fe\left(NO_3\right)_2\right)}=\dfrac{0,1+0,01}{0,2}=0,55M\)