Hòa tan 16,7 g hỗn hợp Zn, ZnO trong dung dịch H2SO4 đặc, nóng ( vừa đủ), thu được 1,568 lít khí SO2 (đktc) là sản phẩm khử duy nhất
a) Viết PTHH. Tính khối lượng của Zn và ZnO
b) Tính khối lượng của muối sunfat thu được
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a)Zn + 2H_2SO_4 \to ZnSO_4 + SO_2 + 2H_2O\\ n_{Zn} = n_{SO_2} = \dfrac{1,568}{22,4} = 0,07(mol)\\ \Rightarrow m_{ZnO} = 16,7 -0,07.65 = 12,15(gam)\\ \%m_{ZnO} = \dfrac{12,15}{16,7}.100\%= 72,75\%\\ b) n_{ZnSO_4} = n_{Zn} + n_{ZnO} = 0,07 + \dfrac{12,15}{81} = 0,22(mol)\\ m_{ZnSO_4} = 0,22.161 = 35,42(gam)\)
\(n_{SO_2}=\dfrac{1.568}{22.4}=0.07\left(mol\right)\)
\(Zn+2H_2SO_{4\left(đ\right)}\underrightarrow{^{t^0}}ZnSO_4+SO_2+2H_2O\)
\(0.07......................................0.07\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(m_{ZnO}=0.07\cdot65=4.55\left(g\right)\)
\(m_{ZnO}=16.7-4.55=12.15\left(g\right)\)
\(\%ZnO=\dfrac{12.15}{16.7}\cdot100\%=72.75\%\)
\(n_{ZnO}=\dfrac{12.15}{81}=0.15\left(mol\right)\)
\(m_{ZnSO_4}=\left(0.07+0.15\right)\cdot161=35.42\left(g\right)\)

Chọn A
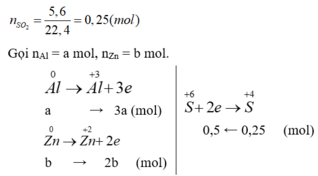
Ta có: m h h = 9 , 2 g → 27a + 65b = 9,2 (*)
Bảo toàn số mol electron có: 3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
m A l = 0 , 1 . 27 = 2 , 7 g a m

Đáp án A.
Gọi nAl = a mol, nZn = b mol.

Ta có: 27a + 65b = 9,2 (*)
3a + 2b = 0,5 (**)
Giải (*), (**): a = b = 0,1 mol.
mAl = 0,1.27 = 2,7 gam

\(a) 2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O\)(Phản ứng oxi hóa-khử)
\(Fe_2O_3 + 3H_2SO_4 \to Fe_2(SO_4)_3 + 3H_2O\)
\(b) n_{SO_2} = \dfrac{672}{1000.22,4} = 0,03(mol)\\ n_{Fe}= \dfrac{2}{3}n_{SO_2} = 0,02(mol)\\ \%m_{Fe} = \dfrac{0,02.56}{2,72}.100\% = 41,18\%\\ \%m_{Fe_2O_3} = 100\% -41,18\% = 58,82\%\)

Đáp án B
Đặt nCu = x(mol); nZn=y(mol)
=> 64x + 65y = 12,9
Bảo toàn electron ta lại có: ne nhường = ne nhận
=> 2 . n Cu + 2 . n Zn = 2 n SO 2 + 6 n S
=> 2x + 2y = 0,4 => x = y = 0,1 (mol)
Vậy phần trăm khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
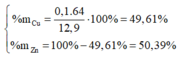

\(n_{Fe}=a\left(mol\right),n_{Zn}=b\left(mol\right)\)
\(m=56a+65b=13.22\left(g\right)\left(1\right)\)
\(n_{H_2}=\dfrac{4.928}{22.4}=0.22\left(mol\right)\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{H_2}=a+b=0.22\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):\)
\(a=0.12\)
\(b=0.1\)
\(\text{Bảo toàn e : }\)
\(n_{Zn}+n_{Fe}=n_{SO_2}=\dfrac{0.12}{2}+\dfrac{0.1}{2}=0.11\left(mol\right)\)
\(V_{SO_2}=0.11\cdot22.4=2.464\left(l\right)\)

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)
\(a) Zn + 2H_2SO_4 \to ZnSO_4 + SO_2 + 2H_2O\\ ZnO + H_2SO_4 \to ZnSO_4 + H_2O\\ n_{Zn} = n_{SO_2} = \dfrac{1,568}{22,4} = 0,07(mol)\\ m_{Zn} = 0,07.65 = 4,55(gam)\\ m_{ZnO} = 16,7-4,55 = 12,15(gam)\\ b) n_{ZnSO_4} = n_{Zn} + n_{ZnO} = 0,07 +\dfrac{12,15}{81} = 0,22(mol)\\ m_{ZnSO_4} = 0,22.161 =35,42(gam) \)
nSO2=1,568/22,4=0,07 mol
Zn + 2H2SO4 đ -to--> ZnSO4 + SO2 + H2O
0,07 0,07 0,07 mol
=>mZn=0,07*65=4,55 g
=>mZnO=16,74,55=12,15 g
nZnO=12,15/81=0,15 mol
ZnO + H2SO4 đ -to--> ZnSo4 +H2O
0,15 0,15
=>nZnSO4 =0,15+0,07=0,22 mol
=> mZnSo4=0,22*161=35,42 g