Đốt cháy 24,8g photpho trong bình chứa 34g khí oxi tạo thành điphotpho pentaoxit P2O5 ( là chất rắn, trắng) a) photpho hay oxi, chất nào còn dư và số mol chất còn dư là bao nhiêu b) Chất nào được tạo thành? Khối lượng là bao nhiêu? Anh chị giải giúp e với ạaaa
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_P=\dfrac{m_P}{M_P}=\dfrac{12,4}{31}=0,4mol\)
\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{17}{32}=0,53125mol\)
\(4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\)
0,4 < 0,53125 ( mol )
0,4 0,5 0,2 ( mol )
\(n_{O_2\left(du\right)}=0,53125-0,5=0,03125mol\)
Chất được tạo thành là P2O5
\(m_{P_2O_5}=n_{P_2O_5}.M_{P_2O_5}=0,2.142=18,4g\)

a) Số mol photpho và khí oxi lần lượt là 12,4:31=0,4 (mol) và 19,2:32=0,6 (mol).
4P (0,4 mol) + 5O2 (0,5 mol) \(\underrightarrow{t^o}\) 2P2O5 (0,2 mol).
Do 0,4:4<0,6:5 nên khí oxi dư 0,6-0,5=0,1 (mol).
b) Điphotpho pentaoxit (P2O5) được tạo thành có khối lượng 0,2.142=28,4 (g).

Bài 2: (chị Hương Giang làm cho bạn bài 1 rồi)
Áp dụng ĐLBTKL, ta có:
mM + mO2 = mM2On
=> mO2 = 4 - 2,4 = 1,6 (g)
nO2 = 1,6/32 = 0,05 (mol)
PTHH: 4M + nO2 -> (to) 2M2On
Mol: 0,2/n <--- 0,05
M(M) = 2,4/(0,2/n) = 12n (g/mol)
Xét:
n = 1 => Loại
n = 2 => M = 24 => Mg
n = 3 => Loại
Vạya M là Mg

a)
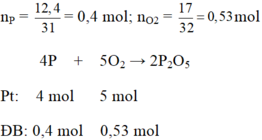
Xét tỉ lệ số mol đề bài với số mol phương trình của P và O2 ta có:

b) Chất tạo thành: đi photpho pentaoxit P2O5
Theo phương trình 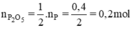
mP2O5 = n.M = 0,2.(31.2 + 16.5) = 28,4 (g)

Bài 4:
a) \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\) => P hết, O2 dư
PTHH: 4P + 5O2 --to--> 2P2O5
0,4-->0,5--------->0,2
=> \(n_{O_2\left(dư\right)}=0,53125-0,5=0,03125\left(mol\right)\)
b) \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\\ 4P+5O_2\rightarrow\left(t^o\right)2P_2O_5\\ Vì:\dfrac{0,4}{4}< \dfrac{0,53125}{5}\Rightarrow O_2dư\\ n_{O_2\left(dư\right)}=\dfrac{5}{4}.0,4=0,5\left(mol\right)\\ \Rightarrow m_{O_2\left(dư\right)}=32.\left(0,53125-0,5\right)=1\left(g\right)\\ n_{P_2O_5}=\dfrac{2}{4}.0,4=0,2\left(mol\right)\\ \Rightarrow m_{P_2O_5}=142.0,2=28,4\left(g\right)\)

a)
Số mol photpho : 0,4 (mol).
Số mol oxi : 0,53 (mol).
Phương trình phản ứng :
4P + 5O2 -> 2P2O5
0,4 0,5 0,2 (mol)
Vậy số mol oxi còn thừa lại là :
0,53 – 0,5 = 0,03 (mol).
b) Chất được tạo thành là P2O5 . Theo phương trình phản ứng, ta có :
0,2 (mol).
Khối lượng điphotpho pentaoxit tạo thành là : m = 0,2.(31.2 + 16.5) = 28,4 gam.
a) PTHH: 4P + 5O2 -to-> 2P2O5
Ta có: \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ n_{O_2}=\dfrac{17}{32}\left(mol\right)\)
Theo PTHH và đề bài, ta có:
\(\dfrac{0,4}{4}< \dfrac{\dfrac{17}{32}}{5}\)
=> P hết, O2 dư nên tính theo nP.
=> \(n_{O_2\left(phảnứng\right)}=\dfrac{5.0,4}{4}=0,5\left(mol\right)\\ =>n_{O_2\left(dư\right)}=\dfrac{17}{32}-0,5=\dfrac{1}{32}\left(mol\right)\)
b) Chất tạo thành sau phản ứng là P2O5 (điphotpho pentaoxit).
Theo PTHH và đề bài, ta có:
\(n_{P_2O_5}=\dfrac{2.0,4}{4}=0,2\left(mol\right)\)
Khối lượng P2O5 tạo thành sau phản ứng:
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{17}{32} = 0,53125(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)$
$\Rightarrow n_{O_2\ dư} = 0,53125 - 0,5 = 0,03125(mol)$
b) Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$


nP = 24.8 / 31 = 0.8 (mol)
nO2 = 34 / 32 = 1.0625 (mol)
4P + 5O2 -to-> 2P2O5
Bđ: 0.8.....1.0625
Pư: 0.8.........1...............0.4
KT : 0..........0.0625.........0.4
mO2 (dư) = 0.0625 * 32 = 2 (g)
mP2O5 = 0.4 * 142 = 56.8 (g)
PTHH: 4P + 5O2 -\(t^0\) --> 2P2O5
ta có n=m/M
=> nP =0,8 và nO2=2,125
theo pt có
nP/4=0,2 < nO2/5=0,425
=> Oxi dư
theo pt
\(\dfrac{nO2\left(pư\right)}{nP}=\dfrac{5}{4}\Rightarrow nO2\left(pư\right)=\dfrac{5}{4}\cdot0,8=1mol\)
nO2(dư)= 2,125-1=1,125mol
b, chất đc tạo thành là: đi photpho penta oxit
theo pt
\(\dfrac{nP2O5}{nP}=\dfrac{2}{4}\Rightarrow nP2O5=\dfrac{2}{4}\cdot0,8=0,4mol\)
ADCT: m=nM
=> mP2O5=0,4*142=56,8g