Hỗn hợp X gồm Al, Fe và kim loại R. Cho 8,7 gam hỗn hợp X vào 200ml dung dịch H2SO4 1,5M thu được dung dịch A, chất rắn B và 4,48 lít H 2 (đktc). Hòa tan hoàn toàn B trong dung dịch H2SO4 đặc nóng dư thu được 1,12l khí SO2 (đktc) và trong dung dịch có chứa 8 gam muối. Xác định R và tính khối lượng các kim loại trong 8,7 gam hỗn hợp X.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Chọn C
Gọi số mol Na, Al và Fe có trong m gam G lần lượt là x, y và z (mol)
Do khi cho G vào nước thu được số mol khí ít hơn khi cho G vào NaOH dư nên khi cho G vào nước dư chỉ có Na phản ứng hết.


a)
$FeO + 2HCl \to FeCl_2 + H_2O$
$Fe + 2HCl \to FeCl_2 + H_2$
$2FeO + 4H_2SO_4 \to Fe_2(SO_4)_3 + SO_2 + 4H_2O$
$2Fe + 6H_2SO_4 \to Fe_2(SO_4)_3 + 3SO_2 + 6H_2O$
b)
n Fe = n H2 = 4,48/22,4 = 0,2(mol)
n SO2 = 7,84/22,4 = 0,35(mol)
Bảo toàn e :
n FeO + 3n Fe = 2n SO2
=> n FeO = 0,35.2 - 0,2.3 = 0,1(mol)
=> m = 0,1.72 + 0,2.56 = 18,4 gam

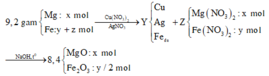
Gọi số mol Mg (x); Fe trong Y là y và Fe trong Z là z
Ta có:
24x + 56y + 56z = 9,2
2x + 3y + 2z = 0,57 ( Bảo toàn e)
40x + 80z = 8,4
⇒ x = 0,15 ; y = 0,07 ; z = 0,03
%Fe = (0,1.56.100)/9,2 = 60,87%
Đáp án D

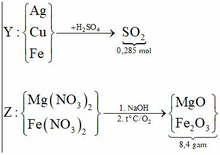
Nhận thấy 9,2 gam oxit > 8,4 gam X → nên Ag+, Cu2+ phản ứng hết
Gọi số mol Fe tham gia phản ứng là y mol, số mol Fe dư là x mol
→ nO2 pư để tạo thành Fe2O3 = y/4 mol
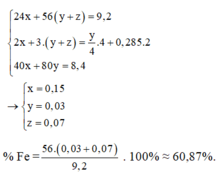
Đáp án A

Đáp án D
(Mg, Fe) + (AgNO3, Cu(NO3)2) => 3 kim loại
=> Chứng tỏ Mg, AgNO3, Cu(NO3)2 phản ứng hết, Fe còn dư; 3 kim loại là Ag, Cu, Fe.
Dung dịch Z chứa Mg(NO3)2 và Fe(NO3)2.
Đặt số mol Mg, Fe phản ứng, Fe dư lần lượt là a, b, c
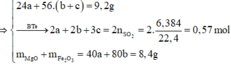
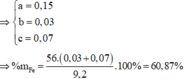


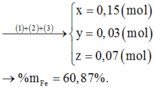
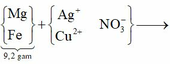

\(n_{H_2SO_4}=0,2.1,5=0,3\left(mol\right)\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Có \(n_{H_2SO_4}>n_{H_2}\)
=> Trong A chứa H2SO4
Vậy kim loại R không tan trong H2SO4 loãng
\(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: 2R + 2nH2SO4 --> R2(SO4)n + nSO2 + 2nH2O
\(\dfrac{0,05}{n}\)<---0,05
=> \(M_{R_2\left(SO_4\right)_n}=\dfrac{8}{\dfrac{0,05}{n}}=160n\left(g/mol\right)\)
=> \(M_R=32n\left(g/mol\right)\)
Xét n = 2 thỏa mãn => MR = 64 (g/mol) => R là Cu
\(n_{Cu}=n_{CuSO_4}=\dfrac{8}{160}=0,05\left(mol\right)\)
Gọi số mol Al, Fe là a,b (mol)
=> 27a + 56b = 8,7 - 0,05.64 = 5,5 (1)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
a----------------------------->1,5a
Fe + H2SO4 --> FeSO4 + H2
b--------------------------->b
=> 1,5a + b = 0,2 (2)
(1)(2) => a = 0,1 (mol); b = 0,05 (mol)
\(\left\{{}\begin{matrix}m_{Al}=0,1.27=2,7\left(g\right)\\m_{Fe}=0,05.56=2,8\left(g\right)\\m_{Cu}=0,05.64=3,2\left(g\right)\end{matrix}\right.\)
\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{H_2SO_4\left(bđ\right)}=0,2.1,5=0,3\left(mol\right)\)
\(\xrightarrow[]{\text{BTNT H}}n_{H_2SO_4\left(pư\right)}=n_{H_2}=0,2\left(mol\right)< 0,3\)
=> H2SO4 dư, mà vẫn có chất rắn B không tan là kim loại R
=> R là kim loại yếu
Đặt R có hoá trị n
\(n_{SO_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ n_{R_2\left(SO_4\right)_n}=\dfrac{8}{2M_R+96n}\left(mol\right)\)
PTHH:
\(2R+2nH_2SO_{4\left(đặc,nóng\right)}\xrightarrow[]{t^o}R_2\left(SO_4\right)_n+nSO_2+2nH_2O\)
\(\dfrac{0,05}{n}\)<-----0,05
\(\rightarrow\dfrac{8}{2M_R+96n}=\dfrac{0,05}{n}\\ \Leftrightarrow M_R=32n\left(g\text{/}mol\right)\)
Xét n = 2 thoả mãn
=> MR = 32.2 = 64 (g/mol)
=> R là Cu
\(n_{Cu}=\dfrac{0,05.2}{2}=0,05\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow27a+56b+0,05.64=8,7\left(1\right)\)
PTHH:
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
a---->1,5a
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2O\)
b----->b
\(\rightarrow1,5a+b=0,2\left(2\right)\)
\(\left(1\right),\left(2\right)\Leftrightarrow\left\{{}\begin{matrix}a=0,1\left(mol\right)\\b=0,05\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{8,7}.100\%=31,03\%\\\%m_{Fe}=\dfrac{0,05.56}{8,7}.100\%=32,18\%\\\%m_{Cu}=100\%-31,03\%-32,18\%=36,79\%\end{matrix}\right.\)