Câu 28: Ngâm 1 đinh sắt sạch trong 200ml dd CuSO4 0,5M, sau khi phản ứng kết thúc. Khối lượng sắt đã phản ứng là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi a là số mol C u S O 4 tham gia phản ứng
Phương trình hóa học:
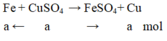
Theo đề bài ta có: m C u b á m v à o – m F e tan r a = m K L t ă n g
64a – 56a = 0,8 ⇒ a = 0,01 mol
Nồng độ dung dịch C u S O 4 là: C M = n V = 0,01 0,2 = 0,5 M
⇒ Chọn C.

Fe + C u S O 4 → Cu + F e S O 4
Theo phương trình cứ 56 gam (1 mol) Fe tan vào 1 mol dung dịch C u S O 4 thì có 64 gam (1 mol) Cu được tạo ra, bám vào thanh sắt làm tăng 8 gam.
Khối lượng đinh sắt tăng 0,8 gam => nCuSO4 = 0,1 mol
Nồng độ mol dung dịch CuSO4 là = 0,1/0,2 = 0,5M.

Fe + CuSO4 → FeSO4 + Cu
1mol 1 mol => tăng 8 gam
x mol x mol tăng 0,8gam
=> x= 0,8:8= 0,1 mol
=> CM ( dung dịch CuSO4) = 0,1:0,2= 0,5 M
Bài 3 :
Pt : \(Fe+CuSO_4\rightarrow FeSO_4+Cu|\)
1 1 1 1
x 0,1 x
Gọi x là số mol của Fe
Vì khối lượng của sắt tăng so với ban đầu nên ta có phương trình :
\(m_{Cu}-m_{Fe}=0,8\left(g\right)\)
64x - 56x = 0,8
8x = 0,8
⇒x = \(\dfrac{0,8}{8}=0,1\)
\(n_{CuSO4}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
200ml = 0,2l
\(C_{M_{ddCuSO4}}=\dfrac{0,1}{0,2}=0,5\left(M\right)\)
Chúc bạn học tốt

n C U S O 4 = x.0,2 mol
F e + C u S O 4 → F e S O 4 + C u
x.0,2 x.0,2 x.0,2 (mol)
Khi nhúng thanh Fe vào dung dịch C u S O 4 , thanh Fe lúc sau có khối lượng tăng lên 1,6 gam là:
m C u b a m v a o - m F e tan = 1,6 g
⇔ 0,2x.64 - 0,2x.56 = 1,6
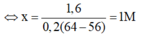
⇒ Chọn C.
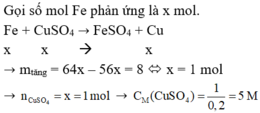

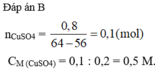

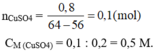
PTHH: \(Fe+CuSO_4\rightarrow FeSO_4+Cu\)
Theo PTHH: \(n_{Fe}=n_{CuSO_4}=0,2\cdot0,5=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1\cdot56=5,6\left(g\right)\)