Câu 16.(2,5 điểm)
Cho 6,5 gam kim loại Zn tác dụng vừa đủ với dung dịch axit HCl,thu
được muối
ZnCl,và giải phóng khí Hạ.
a.Viết phương trình hóa học của phản ứng.
b.Tính thể tích khí Hạ thu được(ởđiều kiện tiêu chuẩn).
c.Tính khối lượng muối ZnCl,tạo thành sau phản ứng.
d.Cho lượng Zn trên vào 150 gam dung dịch axit HC1 7,3%.Hãy tính nồng độ phần
trăm của dung dịch muối thu được sau phản ứng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=n_{ZnCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a) Zn + 2HCl → ZnCl2 + H2
b) mZnCl2 = 0,1 . 136 = 13,6 gam
c) nZn = 6,5/65 = 0,1 mol . Theo tỉ lệ pư => nH2 = nZn = nZnCl2 =0,1 mol <=> VH2(đktc) = 0,1.22,4 = 2,24 lít.

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,1 0,1
\(b,C_M=\dfrac{0,1}{0,1}=1M\)
\(c,V_{H_2}=0,1.22,4=2,24\left(l\right)\)

Số OXH của Fe sau khi tác dụng với dung dịch HCl là +2 còn sau khi td với Cl2 là +3
TN1
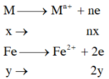
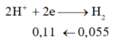
=> nx+2y=0,11 (1)
TN2: Xét cả quá trình
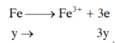
=> nx+3y=0,12 (2)
(1)-(2) được y=0,01
Thay y=0,01 vào (2) được nx=0,09(3)
Lại có: 56.0,01+ xM=1,37
=> Mx=0,81 (4)
(3)(4)=> M=9n
=> Kim loại là Al
Đáp án C

Đáp án : C
X + HCl : Fe -> Fe2+ có nH2 = 0,055 mol
X + Cl2 : Fe -> Fe3+
bảo toàn e : 5nKMnO4 = 2nCl2 => nCl2 = 0,06 mol
Do M có hóa trị không đổi => nFe = ne (2) – ne (1) = 2nCl2 – 2nH2 = 0,01 mol
Giả sử M có hóa trị n => n.nM + 2.0,01 = 2nH2 => n.nM = 0,09 mol
Có : mX = 1,37g = 0,01.56 + nM.M => nM.M = 0,81g
=> M = 9n
Nếu n = 3 => M = 27g (Al) Thỏa mãn

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,1 0,1
\(V_{H_2}=0,1.22,4=2,24\left(l\right)\\ m_{ZnCl_2}=136.0,1=13,6\left(g\right)\)
\(m_{\text{dd}}=6,5+150-\left(0,1.2\right)=156,3\left(g\right)\\ C\%=\dfrac{13,6}{156,3}.100\%=8,7\%\)