cho 5,6g bột fe phản ứng với 500ml dung dịch hno3 1m, phản ứng kết thúc thu được dung dịch x. Dung dịch x hoà tan tối đa m gam cu, biết sản phẩm khử duy nhất của hno3 ở các phản ứng trên là no. tính m
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
nFe = 0,12 mol → ne cho = 0,36 mol; nHNO3 = 0,4 mol → ne nhận = 0,3 mol
- Do ne cho > ne nhận → Fe còn dư → dung dịch X có Fe2+ và Fe3+
- Các phản ứng xảy ra là:
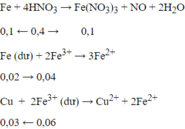
→ mCu = 0,03.64 = 1,92 gam

Đáp án A
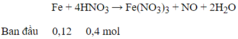
→ HNO3 hết , sau phản ứng có : Fe(NO3)3 0,1 mol ; Fe dư : 0,02 mol
Lượng Cu tối đa đuợc hoà tan hết là khi nó tham gia cả hai phản ứng :
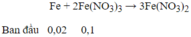
→ Sau phản ứng Fe(NO3)3 dư : 0,1 – 0,04 = 0,06 mol
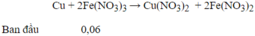
→ Số mol Cu tối đa được hoà tan là : 0,03 mol → m Cu = 0,03.64 = 1,92 gam

Đáp án A
Số mol Fe=0,12(mol) số mol HNO3=0,4 (mol)
Fe+4HNO3→Fe(NO3)3+NO+2H2O Fe + 2Fe(NO3)3→3Fe(NO3)2
0,1 0,4 0,1 0,02 0,04
Fe(NO3)3 dư =0,1-0,04=0,06(mol)
Cu + 2Fe(NO3)3→Cu(NO3)2+2Fe(NO3)2
0,03 0,06
mCu=0,03.64=1,92(g)

Đáp án D
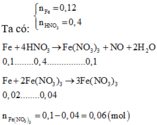
Cu + 2Fe(NO3)3→ Cu(NO3)2+2Fe(NO3)2
0,03 0,06
mCu= 0,03.64 = 1,92(g)


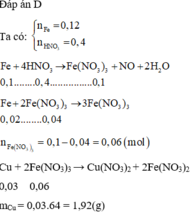


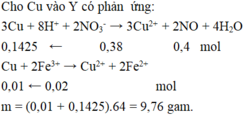

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HNO_3}=1.0,5=0,5\left(mol\right)\)
PTHH: Fe + 4HNO3 --> Fe(NO3)3 + NO + 2H2O
0,1--->0,4---------->0,1
=> dd sau pư chứa \(\left\{{}\begin{matrix}Fe\left(NO_3\right)_3:0,1\left(mol\right)\\HNO_{3\left(dư\right)}:0,5-0,4=0,1\left(mol\right)\end{matrix}\right.\)
PTHH: 3Cu + 8HNO3 --> 3Cu(NO3)2 + 2NO + 4H2O
0,0375<-0,1
2Fe(NO3)3 + Cu --> 2Fe(NO3)2 + Cu(NO3)2
0,1---->0,05
=> m = (0,0375 + 0,05).64 = 5,6 (g)