Hòa tan hoàn toàn 1,35 gam nhôm m gam dung dịch H2SO4 đặc nóng 98% dư thu được a gam muối và V ml khí hidrosunfua. Tính m, a và V
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{FeO}=\dfrac{0,36}{72}=0,005\left(mol\right)\)
\(n_{H_2SO_4}=2n_{FeO}=0,01\left(mol\right)\\ \Rightarrow m_{ddH_2SO_4}=\dfrac{0,01.98}{98\%}=1\left(g\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeO}=0,0025\left(mol\right)\\ \Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,0025.400=1\left(g\right)\)

Đáp án B
Vì H2SO4 đặc nóng dư nên khí A sinh ra là SO2.
Muối khan thu được là
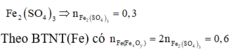
Vì dung dịch NaOH dư nên khỉ dẫn SO2 vào đung dịch NaOH chỉ xảy ra một phản ứng:
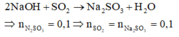
Coi oxit FexOy ban đầu là hỗn hợp của Fe và O.
Gọi nO = a.
Áp dụng định luật bảo toàn moi electron, ta có:


Đáp án : B
Giả sử phản ứng tạo x mol FeSO4 và y mol Fe2(SO4)3
Bảo toàn e : nSO2.2 = 2nFe2+ + 3nFe3+ = 2x + 6y => nSO2 = x + 3y
=> nFe = x + 2y = 0,15 mol
Và nH2SO4 = nSO4( muối ) + nSO2 = x + 3y + x + 3y = 0,4 mol
=> y = 0,05 mol ; x = 0,05 mol
=> mmuối = 27,6g
VSO2 = 22,4. ( 0,05 + 3.0,05 ) = 4,48 lit

PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\) (1)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2+6H_2O\) (2)
\(5SO_2+2KMnO_4+2H_2O\rightarrow2MnSO_4+K_2SO_4+2H_2SO_4\) (3)
Ta có: \(n_{H_2}=0,2\left(mol\right)\)
Theo PT (1): \(n_{Fe}=n_{H_2}=0,2\left(mol\right)\)
Theo PT (2): \(n_{SO_2}=\dfrac{3}{2}n_{Fe}=0,3\left(mol\right)\)
\(\Rightarrow V_{SO_2}=0,3.22,4=6,72\left(l\right)\)
Theo PT (3): \(n_{KMnO_4}=\dfrac{2}{5}n_{SO_2}=0,12\left(mol\right)\)
\(\Rightarrow V_{KMnO_4}=\dfrac{0,12}{2}=0,06\left(l\right)\)
Bạn tham khảo nhé!

Đáp án B
Sau khi hỗn hợp X bị CO lấy
đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron:
3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3:
200a = 18 (2)
+ Giải hệ (1) và (2) ta có:
a = b = 0,09 mol
⇒ mY = 0,09(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi
= 6,48 + 0,04×16 = 7,12 gam

Sau khi hỗn hợp X bị CO lấy đi 1 phần oxi ⇒ Chất rắn Y.
+ Đặt nFe/Y = a và nO/Y = b ta có:
PT bảo toàn electron: 3a – 2b = 2nSO2 = 0,09 mol (1)
PT theo muối Fe2(SO4)3: 200a = 18 (2)
+ Giải hệ (1) và (2) ta có: a = b = 0,09 mol
⇒ mY = 0,09×(56+16) = 6,48 gam.
+ Mà nO bị lấy đi bởi CO = nCaCO3 = 0,04 mol
⇒ nX = mY + mO bị lấy đi = 6,48 + 0,04×16 = 7,12 gam
Đáp án B



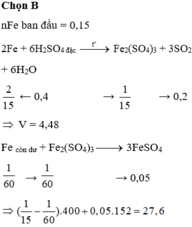
8Al + 15H2SO4 → 4Al2(SO4)3 + 3H2S + 12H2O
\(n_{Al}=\dfrac{1,35}{27}=0,05\left(mol\right)\\ n_{H_2SO_4}=\dfrac{15}{8}n_{Al}=\dfrac{3}{32}\left(mol\right)\\ \Rightarrow m_{ddH_2SO_4}=\dfrac{\dfrac{3}{32}.98}{98\%}=9,375\left(g\right)\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{Al}=0,025\left(mol\right)\\ \Rightarrow m_{Al_2\left(SO_4\right)_3}=0,025.342=8,55\left(g\right)\\ n_{H_2S}=\dfrac{3}{8}n_{Al}=0,01875\left(mol\right)\\ V_{H_2S}=0,01875.22,4=0,42\left(l\right)=420ml\)
\(n_{Al}=\dfrac{1,35}{27}=0,05\left(mol\right)\\ pthh:2Al+6H_2SO_4\rightarrow3SO_2+Al_2\left(SO_4\right)_3+6H_2O\)
0,05 0,15 0,225 0,025
\(m_{H_2SO_4}=0,15.98=14,7\left(g\right)\\ m=m_{\text{dd}\left(H_2SO_4\right)}=\dfrac{14,7.100}{98}=15\left(g\right)\\ m_{Al_2\left(SO_4\right)_3}=0,025.342=8,55g\\ V_{SO_2}=0,225.22,4=5,04l\)
=> \(V_{SO_2\left(ml\right)}=5,04.1000=5040ml\)