Trong giờ thực hành hóa học, học sinh A cho 32,5g kẽm vào dung dịch H₂SO₄ loãng, học sinh B cho 32,5g sắt cũng vào dung dịch H₂SO₄ loãng ở trên. Hãy cho biết học sinh nào thu được khí hidro nhiều hơn (đo ở cùng điều kiện nhiệt độ, áp suất)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


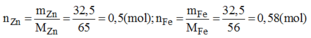
PTPU:
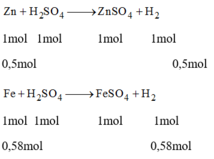
Vậy thí nghiệm của học sinh B sẽ thu được nhiều khí hidro hơn.

\(PTHH:Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)(1)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)(2)
Ta có: \(m_{Zn}=m_{Al} \)
\(M_{Zn}>M_{Al}\)
\(\Rightarrow n_{Zn}< n_{Al}\)
Mặt khác :
Theo PT(1): \(n_{H_2}=n_{Zn}\)
Theo PT(2):\(n_{H_2}=\frac{3}{2}n_{Al}\)
=> \(n_{H_2\left(pt2\right)}>n_{H_2\left(pt1\right)}\)
=>\(V_{H_2\left(pt2\right)}>V_{H_2\left(pt1\right)}\)
(Đây là cách làm theo lập luận không cần tính nếu bạn muốn chắc chắn thì tìm nZn ; nAl rồi theo PT tính nH2 ; VH2 bình thường cũng ra kết quả như trên .)

a, \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
b, \(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
c, \(n_{ZnSO_4}=n_{Zn}=0,3\left(mol\right)\Rightarrow m_{ZnSO_4}=0,3.161=48,3\left(g\right)\)
d, \(n_{Fe_2O_3}=\dfrac{64}{160}=0,4\left(mol\right)\)
PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,4}{1}>\dfrac{0,3}{3}\), ta được Fe2O3 dư.
Mà: H% = 30% \(\Rightarrow n_{H_2\left(pư\right)}=0,3.30\%=0,09\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe}=\dfrac{2}{3}n_{H_2}=0,06\left(mol\right)\\n_{Fe_2O_3\left(pư\right)}=\dfrac{1}{3}n_{H_2}=0,03\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow n_{Fe_2O_3\left(dư\right)}=0,4-0,03=0,37\left(mol\right)\)
\(\Rightarrow a=m_{Fe}+m_{Fe_2O_3\left(dư\right)}=62,56\left(g\right)\)

Thí nghiệm nào sau đây chỉ có xảy ra hiện tượng ăn mòn hóa học?
A. Một mẫu gang để ngoài không khí ẩm.
B. Nối dây kẽm với dây đồng rồi cho vào dung dịch HCl
. C. Cho lá sắt vào dung dịch HNO3 loãng.
D. Ngâm lá kẽm trong dung dịch CuSO4.

PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
Ta có: \(n_{Zn}=\dfrac{32,5}{65}=0,5\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{HCl}=1\left(mol\right)\\n_{H_2}=0,5\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{ddHCl}=\dfrac{1\cdot36,5}{20\%}=182,5\left(g\right)\\V_{H_2}=0,5\cdot22,4=11,2\left(l\right)\end{matrix}\right.\)

a, \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,3\left(mol\right)\Rightarrow V_{H_2}=0,3.22,4=6,72\left(l\right)\)
b, \(n_{CuO}=\dfrac{4,8}{80}=0,06\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,06}{1}< \dfrac{0,3}{1}\), ta được H2 dư.
Chất rắn thu được sau pư là Cu.
Theo PT: \(n_{Cu}=n_{CuO}=0,06\left(mol\right)\Rightarrow m_{Cu}=0,06.64=3,84\left(g\right)\)
c, Ta có: \(n_{Mg}=\dfrac{5,4}{24}=0,225\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{H_2}=n_{Mg}=0,225\left(mol\right)\)
Có: 0,3 > 0,225 → bạn A thu được nhiều khí H2 hơn.
nZn= 32,5/65=0,5 mol
Zn + H2SO4 --> ZnSO4 + H2
0,5 0,5 => VH2= 0,5*22,4=11,2 lít
nFe=32,5/56=65/112mol
Fe + H2SO4 --> FeSO4 + H2
65/112 65/112 => VH2=65/112*22,4=13 lít
=>fe sẽ tạo nhiều H2 hơn Zn