Cho 9,6 gam Mg tác dụng vừa đủ với dung dịch axit H2SO4 đặc thu được muối sunfut, 0,4 mol khí X(sản phẩm khử duy nhất) và nước.X là gì?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.

Do khí A là sản phẩm khử duy nhất nên muối khan chỉ có R(NO3)n (n là hóa trị cao nhất của kim loại R)
Ta luôn có nR= n R ( N O 3 ) ) n nên
m R m R ( N O 3 ) n = R R + 62 n = 9 , 6 59 , 2
→R=12n
Vì n chỉ nhận giá trị 1, 2, 3 nên ta thấy chỉ có n=2, R=24(Mg) là thỏa mãn
nMg=0,4mol, nkhí= 0,1mol
Quá trình cho e:
Mg→ Mg2++ 2e (1)
0,4→ 0,8 mol
Quá trình nhận e:
-Nếu khí có 1 nguyên tử N:
N+5 + (5-a) e→ N+a
(5-a).0,1 0,1
Theo ĐL bảo toàn electron có: 0,8= 0,1. (5-a)→ a= -3 loại
-Nếu khí có 2 nguyên tử N:
2N+5 + 2(5-a) e→ N2+a
(5-a).0,2 0,1
Theo ĐL bảo toàn electron có: 0,8= 0,2. (5-a)→ a= 1→ Khí là N2O
Đáp án D

Đáp án A
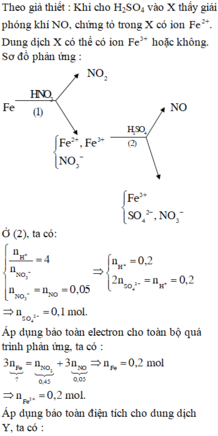
X là NO
=> nNH4NO3 = ¼ nHNO3 = 0,45 mol và nNO3 muối KL = nHNO3 – nNO = 1,35 mol
=> mmuối = mKL + mNO3 muối KL = 96,66g

Đáp án D
+ N ế u h ỗ n h ợ p c h ỉ c ó A l t h ì n A l = 12 , 96 27 = 0 , 48 ⇒ n e n h ư ờ n g = 1 , 44 N ế u h ỗ n h ợ p c h ỉ c ó M g t h ì n A l = 12 , 96 24 = 0 , 54 ⇒ n e n h ư ờ n g = 1 , 08 ⇒ 1 , 08 < n e n h ư ờ n g g < 1 , 44 1 , 8 1 , 44 = 1 , 25 < n H + n e n h ư ờ n g ( n e n h ậ n ) < 1 , 8 1 , 08 = 1 , 667 ⇒ S P K l à N O . + n N O 3 - t ạ o m u ố i = n e n h ậ n = 3 n N O = 3 x n H N O 3 = n N O 3 - t ạ o m u ố i + n N O = 4 x = 1 , 8 ⇒ x = 0 , 45 m m u ố i = m k i m l o ạ i ⏟ 12 , 96 + m N O 3 - t a ọ m u ố i ⏟ 0 , 45 . 3 . 62 = 96 , 66
Bảng mối liên hệ giữa n H + n e l e c t r o n n h ậ n và sản phẩm khử:
| 2 H + + N O 3 - + 1 e → N O 2 + H 2 O |
n H + n e l e c t r o n n h ậ n = 2 |
| 4 H + + N O 3 - + 3 e → N O + 2 H 2 O |
n H + n e l e c t r o n n h ậ n = 1 , 333 |
| 10 H + + 2 N O 3 - + 8 e → N 2 O + 5 H 2 O |
n H + n e l e c t r o n n h ậ n = 1 , 25 |
| 12 H + + 2 N O 3 - + 10 e → N 2 + 6 H 2 O |
n H + n e l e c t r o n n h ậ n = 1 , 2 |
| 10 H + + N O 3 - + 8 e → N H 4 + + 3 H 2 O |
n H + n e l e c t r o n n h ậ n = 1 , 25 |

`2Fe + 6H_2 SO_[4(đ,n)] -> Fe_2(SO_4)_3 + 3SO_2 \uparrow + 6H_2 O`
`0,05` `0,15` `0,025` `(mol)`
`Cu + 2H_2 SO_[4(đ,n)] -> CuSO_4 + SO_2 \uparrow + 2H_2 O`
`0,225` `0,45` `0,225` `(mol)`
`n_[SO_2]=[6,72]/[22,4]=0,3(mol)`
Gọi `n_[Fe]=x` ; `n_[Cu]=y`
`=>` $\begin{cases} \dfrac{3}{2}x+y=0,3\\56x+64y=17,2 \end{cases}$
`<=>` $\begin{cases}x=0,05\\y=0,225 \end{cases}$
`@m_[Fe_2(SO_4)_3]=0,025.400=10(g)`
`@m_[CuSO_4]=0,225.160=36(g)`
`@m_[dd H_2 SO_4]=[(0,15+0,45).98]/80 .100=73,5(g)`
Sửa đề: 80% ---> 98% (80% chưa đặc nên không giải phóng SO2 được)
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Cu}=b\left(mol\right)\end{matrix}\right.\)
\(\rightarrow56a+64b=17,2\left(1\right)\)
PTHH:
\(2Fe+6H_2SO_{4\left(đặc,nóng\right)}\rightarrow Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
a------>3a------------------->0,5a--------------->1,5a
\(Cu+2H_2SO_{4\left(đặc,nóng\right)}\rightarrow CuSO_4+SO_2\uparrow+2H_2O\)
b----->2b------------------->b------------->b
\(\rightarrow1,5a+b=\dfrac{6,72}{22,4}=0,3\left(2\right)\)
Từ \(\left(1\right)\left(2\right)\rightarrow\left\{{}\begin{matrix}a=0,05\left(mol\right)\\b=0,225\left(mol\right)\end{matrix}\right.\)
\(\rightarrow\left\{{}\begin{matrix}m_{Fe_2\left(SO_4\right)_3}=0,5.0,05.400=10\left(g\right)\\m_{CuSO_4}=0,225.160=36\left(g\right)\\m_{ddH_2SO_4}=\dfrac{\left(0,05.3+0,225.2\right).98}{98\%}=60\left(g\right)\end{matrix}\right.\)

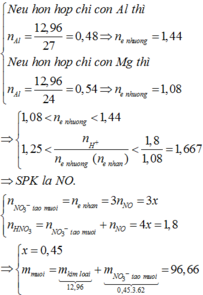

$n_{Mg}=0,4(mol)$
Đặt $a$ là số oxi hóa của $S$ trong $X$
$Mg^0\to Mg^{+2}+2e$
$S^{+6}+(6-a)e\to S^a$
Bảo toàn e: $2n_{Mg}=(6-a)n_S$
$\to 0,8=(6-a).0,4$
$\to a=4$
$\to X$ là $SO_2$
`Mg + H_2 SO_[4(đ)] -> MgSO_4 + H_2 O + SO_2↑`
`-> X` là khí `SO_2`