Dẫn 11,2 lít hỗn hợp khí (ở đktc) gồm O2 và O3 đi qua dung dịch KI dư thấy có 31,75 gam chất rắn màu tím đen. Xác định thành phần phần trăm theo thể tích của khí oxi trong hỗn hợp ban đầu. Câu 3. Để oxi hóa hoàn toàn 1,67 gam hỗn hợp Al, Mg và Zn cần V lít khí O2 (ở đktc), sau phản ứng thu được 2,63 gam oxit. Xác định thể tích oxi (V) tham gia phản ứng là. (Biết O = 16; Al = 27; Mg = 24; Zn = 65)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A.
n X = 0 , 05 ( m o l ) n I 2 = 0 , 025 ( m o l ) O 3 + 2 K I + H 2 O → 2 K O H + O 2 + I 2 0 , 025 ← 0 , 025 ( m o l ) % V O 3 = 0 , 025 0 , 05 . 100 % = 50 %

\(n_{I_2}=\dfrac{12,7}{254}=0,05\left(mol\right)\)
PTHH: 2KI + O3 + H2O --> 2KOH + I2 + O2
0,05<----------------0,05
=> \(\%V_{O_3}=\dfrac{0,05.22,4}{3,36}.100\%=33,33\%\)
=> \(\%V_{O_2}=100\%-33,33\%=66,67\%\)

a, \(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
_____0,15____0,3 (mol)
\(\Rightarrow\%V_{C_2H_2}=\dfrac{0,15.22,4}{11,2}.100\%=30\%\)
\(\Rightarrow\%V_{CH_4}=100-30=70\%\)
b, - Khí thoát ra ngoài là CH4.
\(V_{CH_4}=11,2.70\%=7,84\left(l\right)\)

a, Cho hỗn hợp khí CH4 và C2H4 qua dung dịch Br2 dư chỉ có C2H4 tham gia phản ứng. PTHH: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{Br_2}=\dfrac{m_{Br_2}}{M_{Br_2}}=\dfrac{64}{160}=0,4(mol)\)
Theo PTHH: \(n_{C_2H_4}=n_{Br_2}=0,4(mol)\)
\(V_{C_2H_4}=n_{C_2H_4}.22,4=0,4.22,4=8,96(l)\)
Phần trăm của khí C2H4 trong hỗn hợp ban đầu là: \(\%V_{C_2H_4}=\dfrac{V_{C_2H_4}}{V_hh}.100\%=\dfrac{8,96}{11,2}.100\%=80\%\)
Phần trăm của khí CH4 trong hỗn hợp ban đầu là:
\(\%V_{CH_4}=100\%-\%V_{C_2H_4}=100\%-80\%=20\%\)

a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
b, - Khí thoát ra là CH4 ⇒ VCH4 = 6,72 (l)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{6,72}{13,44}.100\%=50\%\\\%V_{C_2H_2}=50\%\end{matrix}\right.\)
a. PTHH: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
a. Vì CH4 không phản ứng với dd Br2 nên
\(V_{CH_4}=6,72\left(l\right)\)
\(\%V_{CH_4}=\dfrac{6,72}{13,44}x100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Ta có: \(n_{C_2H_4}+n_{C_2H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\left(1\right)\)
Theo PT: \(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=\dfrac{48}{160}=0,3\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,2.22,4}{5,6}.100\%=80\%\\\%V_{C_2H_2}=20\%\end{matrix}\right.\)
b, \(V_{ddBr_2}=\dfrac{0,3}{0,25}=1,2\left(M\right)\)
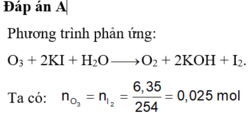
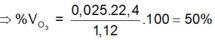
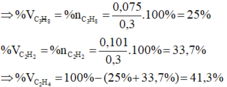
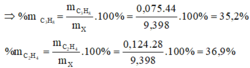
bài 1
H2O+2KI+O3->I2+2KOH+O2
0,25---0,25
n I2=0,25 mol
=>%VO3=\(\dfrac{0,25.22,4}{11,2}100=50\%\\ \)
=>%VO2=50%
bài 2
BTKLg:
m O2=2,63-1,67=0,96g
=>n O2=0,03 mol
=>VO2=0,03.22,4=0,672l
`H2O + 2KI + O3 -> I2 + 2KOH + O2`
`0,25 ----- 0,25`
`n l2 = 0,25` `mol`
`=> %VO3 = (0,25 . 22,4)/(11,2) . 100 = 50%`
`=> $ VO2 = 50%`
_________________________________
`m O2 = 2,63 - 1,67 = 0,96 g`
`=> n O2 = 0,03` `mol`
`=>` `VO2 = 0,03 . 22,4 = 0,672l`