đốt nóng 1 hh gồm 6,4g S vào bột kẽm dư trong môi trường kín không có không khí. khối lượng muối thu đc sau p.ứ là:
a. 19,4g b.4,85g c. 14,55g d.19,40g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Al_2S_3}=\dfrac{45}{150}=0,3\left(mol\right)\)
Bảo toàn Al: nAl = 0,6 (mol)
=> a = 0,6.27 = 16,2 (g)
=> C

mFeS=(12+6,4)-0,8
=18,4-0,8
=17,6(g)
vậ̣y khối lượng FeS thu được là17,6g

Do hòa tan X vào dd HCl dư thu được hỗn hợp khí
=> Trong X chứa Fe
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\); \(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
0,2<-0,2---->0,2
Fe + 2HCl --> FeCl2 + H2
0,1------------------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,2---------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=\dfrac{0,2}{0,1+0,2}.100\%=66,67\%\end{matrix}\right.\)
\(n_{Fe}=\dfrac{16,8}{56}=0,3\left(mol\right)\\ n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
PTHH: Fe + S --to--> FeS
LTL: 0,3 > 0,2 => Fe dư
Theo pthh: nFe (pư) = nS = nFeS = 0,2 (mol)
=> nFe (dư) = 0,3 - 0,2 = 0,1 (mol)
PTHH:
Fe + 2HCl ---> FeCl2 + H2
0,1------------------------->0,1
FeS + 2HCl ---> FeCl2 + H2S
0,2--------------------------->0,2
=> \(\left\{{}\begin{matrix}\%V_{H_2}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\\\%V_{H_2S}=100\%-33,33\%=66,67\%\end{matrix}\right.\)

a)
$n_{Zn} = 0,01(mol) ; n_{S} =0,007(mol)$
$Zn + S \xrightarrow{t^o} ZnS$
$n_{Zn} > n_S$ nên Zn dư
$n_{ZnS} = n_{Zn\ pư} = n_S = 0,007(mol)
Sau phản ứng :
$m_{ZnS} = 0,007.97 = 0,679(gam)$
$m_{Zn\ dư} = (0,01 - 0,007).65 = 0,195(gam)$
b)
2Zn + O2 \(\xrightarrow{t^o}\) 2ZnO
0,01.................0,01........(mol)
S + O2 \(\xrightarrow{t^o}\) SO2
0,007................0,007..............(mol)
Sau phản ứng :
$m_{ZnO} = 0,01.81 = 0,81(gam)$
$m_{SO_2} = 0,007.64 = 0,448(gam)$

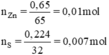
⇒ S phản ứng hết, Zn phản ứng dư
Phương trình hóa học của phản ứng
Zn + S 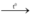 ZnS
ZnS
nZn phản ứng = 0,007 mol ⇒ nZnS = 0,007 mol.
Khối lượng các chất sau phản ứng:
mZn dư = (0,01 – 0,007) × 65 = 0,195g.
mZnS = 0,007 × 97 = 0,679g.

nZn=0,01, nS=0,007Zn+S→ZnS0,007 0,007 0,007
Sau phản ứng có 0,007 mol ZnS và 0,003mol Zn dư
ủa! trong H24 HOC24 có chữ màu ak??????
hồi giờ mik hk piết ak

\(n_S=\frac{0,224}{32}=0,007mol\)
\(n_{Zn}=\frac{0,650}{65}=0,01mol\)
\(n_S\)\(<\)\(n_{Zn}\)
\(\rightarrow\) chất dư là Zn, số mol của pt tính theo S:
Zn + S \(\rightarrow\) ZnS
0,007 0,007 0,007 ( mol )
Sau pư chất thu được trong ống nghiệm là: Zn dư ; ZnS
\(n_{Zn\left(dư\right)}=0,01-0,007=0,003\left(mol\right)\)
\(m_{ZnS}=0,007.97=0,697\left(g\right)\)
\(m_{Zn\left(dư\right)}=0,003.65=0,195\left(g\right)\)
\(n_S=\dfrac{6,4}{32}=0,2\left(mol\right)\)
Bảo toàn S: nZnS = 0,2 (mol)
=> mZnS = 0,2.97 = 19,4 (g)
=> A
lời cảm ơn đến hơi muộn nhưng vẫn cảm ơn anh ạ