Hỗn hợp X gồm CH4 và O2 theo tỉ lệ thể tích là 1:3. Hốn hợp Y gồm CO2 và O2 theo tỉ lệ thể tích là 1:1. Tìm tỉ khối của Y so với X
Giải gấp giùm em được không ạ? Em đang cần gấp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C
Sử dụng sơ đồ đường chéo ⇒ nO2:nO3 = 5:3
+ Giả sử nCO2 6 mol và nH2O = 7 mol ta có sơ đồ.
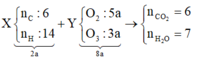
+ Bảo toàn Oxi ⇒ 2nO2 + 3nO3 = 5x2a + 3x3a = 2nCO2 + nH2O = 6x2 + 7 = 19 ⇒ a = 1
![]()
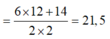
⇒ Chọn C

Chọn đáp án C
Sử dụng sơ đồ đường chéo ⇒ nO2:nO3 = 5:3
+ Giả sử nCO2 6 mol và nH2O = 7 mol ta có sơ đồ.
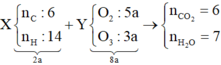
+ Bảo toàn Oxi ⇒ 2nO2 + 3nO3 = 5x2a + 3x3a = 2nCO2 + nH2O = 6x2 + 7 = 19 ⇒ a = 1
![]()
⇒ Chọn C

Đáp án A
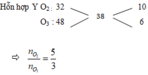
Giả sử số mol của Y = 0,8 mol => nX = 0,4mol
Bảo toàn nguyên tố O => 2nO2 + 3nO3 = 2nCO2 + nH2O = 1,9
nCO2 : nH2O = 6:7
=> nCO2 = 0,6 và nH2O = 0,7 mol
mX = mC + mH = 0,6 . 12 + 0,7 . 2 = 8,6g
=> MX = 8,6 : 0,4 = 21,5
dX/H2 = 10,75

Chọn nCO2 = 6 , nH2O = 7
Hỗn hợp Y gồm nO2 = a mol, nO3 = b mol
X + Y → CO2 + H2O
Áp dụng ĐLBT nguyên tố O: 2a + 3b = 6.2 + 7
mY = 32a + 48b = 19.2 (a+b)
=> a = 5 và b = 3
=> nX = 1/2 nY = 4 mol
=> mX = 6.44 + 7.18 - 32.5 - 48.3 = 83 gam
<=> MX = \(\dfrac{m_X}{n_X}\)= 20,75 gam/mol
<=> d\(\dfrac{X}{H_2}\)= 20,75:2 = 10,375
\(M_X=\dfrac{16+32.3}{1+3}=28\left(\dfrac{g}{mol}\right)\\ M_Y=\dfrac{44+32}{1+1}=38\left(\dfrac{g}{mol}\right)\\ \rightarrow d_{Y/X}=\dfrac{38}{28}=1,36\)
\(M_X=16+32.3=112\left(\dfrac{g}{mol}\right)\\ M_Y=44+32=76\left(\dfrac{g}{mol}\right)\\ \)
dMy/Mx = \(\dfrac{76}{112}=\dfrac{19}{28}\)