Cho a gam dung dịch H2SO4 nồng độ A% tác dụng hết với một lượng hỗn hợp hai kim loại Na và Zn (dùng dư), thấy khối lượng khí hiđro bay ra là 0,05a gam. Tính A
tính bằng cách dùng mol của h2so4 vs h2 nhé
e cảm ơn
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Chọn m = 100 (gam). Vì kim loại dùng dư nên sau khi axit hết, K tác dụng với nước cũng sinh H2.
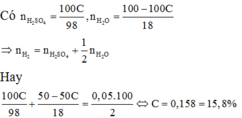

Đặt a=100 (g)
Theo đề ta có các PTHH:
\(2K+H_2SO_4\xrightarrow[]{}K_2SO_4+H_2\)(1)
\(Mg+H_2SO_4\xrightarrow[]{}MgSO_{4_{ }}+H_2\)(2)
\(2K+2H_2O\xrightarrow[]{}2KOH+H_2\) (3)
(K dùng dư nên cũng tác dụng với H2O)
Theo đề: \(m_{H_2SO_4}=100\times A\%=A\left(g\right)\)
=> \(n_{H_2SO_4}=\dfrac{A}{98}\left(mol\right)\)
\(n_{H_2}=\dfrac{0,05\times100}{2}=2,5\left(mol\right)\)
\(m_{H_2O}=m_{ddH_2SO_4}-m_{H_2SO_4}=100-A\left(g\right)\)
=>\(n_{H_2O}=\dfrac{100-A}{18}\left(mol\right)\)
Theo PTHH(1),(2),(3) ta có:
\(n_{H_2}=n_{H_2SO_4}+\dfrac{1}{2}\times n_{H_2O}=\dfrac{A}{98}+\dfrac{1}{2}\times\dfrac{100-A}{18}=\dfrac{A}{98}+\dfrac{100-A}{36}=2,5\left(mol\right)\)
=> A=15,8
Vậy nồng độ dung dịch H2SO4 là 15,8%
\(PTHH:\)
\(H_2SO_4+2K--->K_2SO_4+H_2\) \((1)\)
\(H_2SO_4+Mg--->MgSO_4+H_2\) \((2)\)
\(mH_2SO_4=\)\(\dfrac{C\%H_2SO_4.mddH_2SO_4}{100}\)\(=\)\(\dfrac{Aa}{100} (g)\)
\(=> nH_2SO_4=\dfrac{Aa}{100}.98=0,98Aa (mol)\)
\(nH_2=\dfrac{0,05a}{2} = 0,025a (mol)\)
Theo PTHH (1) và (2) \(nH_2SO_4=nH_2\)
\(<=> 0,98Aa=0,025a\)
\(<=> 0,98A=0,025\)
\(<=> A=39,2 \)
Vậy nồng độ phần trăm của dung dich \(H_2SO_4\) cần tìm là \(39,2\%\)

$m_{H_2SO_4} = a.C\%(gam) \Rightarrow n_{H_2SO_4} = \dfrac{a.C\%}{98}$
$m_{H_2O\ trong\ dd\ axit} = a - a.C\% \Rightarrow n_{H_2O} = \dfrac{a - a.C\%}{18}$
$2Na + H_2SO_4 \to Na_2SO_4 + H_2$
$Mg + H_2SO_4 \to MgSO_4 + H_2$
$2Na + 2H_2O \to 2NaOH + H_2$
Theo PTHH :
$n_{H_2} = n_{H_2SO_4} + \dfrac{1}{2}n_{H_2O}$
$\Rightarrow \dfrac{0,05a}{2} = \dfrac{a.C\%}{98} + \dfrac{1}{2}.\dfrac{a - a.C\%}{18}$
$\Rightarrow C\% = 0,158 = 15,8\%$

\(n_{H_2} = \dfrac{0,05a}{2} = 0,025a(mol)\\ n_{HCl} = \dfrac{a.C\%}{36,5} = \dfrac{a.C}{3650}(mol)\\ n_{H_2O} = \dfrac{a-a.C\%}{18}(mol)\)
\(Na + HCl \to NaCl + \dfrac{1}{2}H_2\\ K + HCl \to KCl + \dfrac{1}{2}H_2\\ Na + H_2O \to NaOH + \dfrac{1}{2}H_2\\ K + H_2O \to KOH + \dfrac{1}{2}H_2\\ 2n_{H_2} = n_{HCl} + n_{H_2O}\\ \Rightarrow 0,025a.2 = \dfrac{a.C}{3650} + \dfrac{a-a.C\%}{18}\)
\(\Leftrightarrow 0,05 = \dfrac{C}{3650} + \dfrac{1-0,01C}{18}\\ \Rightarrow C = 19,72\)

a)
\(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,25-->0,25------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b) \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,25}{0,3}=\dfrac{5}{6}M\)
c) \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,25}{3}\) => Fe2O3 dư, H2 hết
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
\(\dfrac{0,25}{3}\) <--0,25----->\(\dfrac{0,5}{3}\)
=> \(m=32-\dfrac{0,25}{3}.160+\dfrac{0,5}{3}.56=28\left(g\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
đb: 0,25
a) số mol của Zn là: \(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
Theo PTHH, ta có: \(n_{H_2}=\dfrac{0,25\cdot1}{1}=0,25\left(mol\right)\)
Thể tích của H2 ở đktc là: \(V_{H_2\left(đktc\right)}=n_{H_2}\cdot22,4=0,25\cdot22,4=5,6\left(l\right)\)
2 câu còn lại mk chịu

`Zn + H_2 SO_4 -> ZnSO_4 + H_2`
`0,25` `0,25` `0,25` `(mol)`
`n_[Zn]=[16,25]/65=0,25(mol)`
`a)V_[H_2]=0,25.22,4=5,6(l)`
`b)C_[M_[H_2 SO_4]]=[0,25]/[0,3]~~0,8(M)`
`c)`
`H_2 + 3Fe_2 O_3` $\xrightarrow{t^o}$ `2Fe_3 O_4 + H_2 O`
`1/15` `0,2` `2/15` `(mol)`
`n_[Fe_2 O_3]=32/160=0,2(mol)`
Ta có:`[0,25]/1 > [0,2]/3`
`=>H_2` dư
`=>m_[Fe_3 O_4]=2/15 . 232~~30,93(g)`
\(2Na+H_2SO_4\rightarrow Na_2SO_4+H_2\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(nH_2=\dfrac{0,05}{2}=0,025\left(mol\right)\)
=>\(nH_2SO_4=0,025\left(mol\right)\)
=> \(mH_2SO_4=0,025.98=2,45\left(g\right)\)
- muốn tính C% H2SO4 cần thêm dữ kiện .