Cho m(g) hỗn hợp đồng và sắt vào dung dịch H2SO4 loãng dư thu được 0,1 (mol) khí H2 (đktc). Cũng cho m(g) hỗn hợp trên vào dung dịch H2SO4 đặc nóng thì thu được 4,48 lít SO2 (đktc). Tính m?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{SO_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
PTHH:
Zn + H2SO4 (loãng) ---> ZnSO4 + H2
0,2<--------------------------------------0,2
Zn + 2H2SO4 (đặc) ---> ZnSO4 + SO2↑ + 2H2O
0,2--->0,4------------------------------->0,2
Cu + 2H2SO4 ---> CuSO4 + SO2↑ + 2H2O
0,2<--0,4<------------------------0,2
b, \(\left\{{}\begin{matrix}m_{Zn}=0,2.65=13\left(g\right)\\m_{Cu}=0,2.64=12,8\left(g\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{Zn}=\dfrac{13}{13+12,8}.100\%=50,4\%\\\%m_{Cu}=100\%-50,4\%=49,6\%\end{matrix}\right.\)
c, PTHH:
SO3 + H2O ---> H2SO4
0,4<---------------0,4
2SO2 + O2 --to, V2O5--> 2SO3
0,4<---------------------------0,4
4FeS2 + 11O2 --to--> 2Fe2O3 + 8SO2
0,2<--------------------------------------0,4
=> \(m_{FeS_2}=\dfrac{0,2.120}{100\%-20\%}=30\left(g\right)\)

nH2=4,48/22,4=0,2 mol
Fe +2HCl -->FeCl2+H2
0,2 0,2 mol
=>mFe=0,2*56=11,2 g
nSO2=10,08/22,4=0,45 mol
gọi số mol của Cu là a mol
bảo toàn e ta có
Cu\(^0\)-->Cu\(^{+2}\)+2e
a 2a S\(^{+6}\) + 2e -->S\(^{+4}\)
Fe\(^0\)--> Fe\(^{+3}\)+3e 0,45 0,9
0,2 0,6
=>a=0,15=>mCu=0,15*64=9,6 g
=>mhh=9,6+11,2=20,8g
=>%Cu=9,6*100/20,8=46,15%

Đáp án D
Hỗn hợp phản ứng với H2SO4 loãng dư chỉ có Fe phản ứng (vì Cu đứng sau H)
Hỗn hợp phản ứng với H2SO4 đặc nguội dư thì chỉ có Cu phản ứng (Fe bị thụ động)
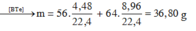

Đáp án D
Có 
=> ![]()
gam gần nhất với giá trị 36,82
=> Chọn đáp án D.

Đáp án D.
Có n F e = n H 2 = 4 , 48 22 , 4 = 0 , 2 m o l n C u = n S O 2 = 8 , 96 22 , 4 = 0 , 4 m o l ⇒ m = 56 . 0 , 2 + 64 . 0 , 4 = 36 , 8 g a m
gần nhất với giá trị 36,82

Chọn C
Gọi số mol Na, Al và Fe có trong m gam G lần lượt là x, y và z (mol)
Do khi cho G vào nước thu được số mol khí ít hơn khi cho G vào NaOH dư nên khi cho G vào nước dư chỉ có Na phản ứng hết.


-Đặt số mol của Mg và kim loại M lần lượt là : x và y
Các phương trình hóa học:
Mg + 2HCl → MgCl2 + H2
x................................................x
2M + 2nHCl → 2MCln + nH2 (có thể có)
y...................................................\(\dfrac{ny}{2}\)
Mg + 2H2SO4 → MgSO4 + SO2 + 2H2O
x....................................................x
2M + 2mH2SO4 → M2(SO4)m + mSO2 + 2mH2O
y ..........................................................\(\dfrac{my}{2}\) ![]()
Số mol của H2 là : \(\dfrac{8,96}{22,4}\) = 0,4 mol
Số mol của SO2 là : \(\dfrac{11,2}{22,4}\) = 0,5 mol
Trường hợp 1. Kim loại M không phản ứng với dung dịch HCl.
Theo bài ra và các phương trình trên ta có :
24x + My = 16 (1)
x = 0,4 (2)
x + \(\dfrac{my}{2}\)= 0,5 (3)
Từ (1), (2), (3) ta có : M = 32m
-Nếu m = 1 → M = 32 (loại)
-Nếu m = 2 → M = 64 (Cu)
-Nếu m = 3 → M = 96 (loại)
\(\rightarrow\)Vậy kim loại M là Cu
- Trường hợp 2. Kim loại M phản ứng với dung dịch HCl.
Theo bài ra và các phương trình trên ta có :
24x + My = 16 (4)
x +\(\dfrac{ny}{2}\) = 0,4 (5)
x + \(\dfrac{my}{2}\)= 0,5 (6)
Theo (5) và (6) thấy m > n
|
n |
1 | 1 | 2 |
|
m |
2 |
3 |
3 |
|
x |
0,3 |
0,35 |
0,2 |
|
y |
0,2 |
0,1 |
0,2 |
|
M |
44 (loại) |
76 (loại) |
56 (Fe) |
Vậy kim loại M là Fe
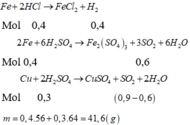

PTHH: \(Fe+H_2SO_{4\left(l\right)}\rightarrow FeSO_4+H_2\uparrow\)
\(2Fe+6H_2SO_{4\left(đ\right)}\underrightarrow{t^o}Fe_2\left(SO_4\right)_3+3SO_2\uparrow+6H_2O\)
\(Cu+2H_2SO_{4\left(đ\right)}\underrightarrow{t^o}CuSO_4+SO_2\uparrow+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Fe}=n_{H_2}=0,1\left(mol\right)\\n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,1\left(mol\right)\\n_{Cu}=0,05\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Cu}+m_{Fe}=0,1\cdot56+0,05\cdot64=8,8\left(g\right)\)
Giả sử: \(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
_ Khi pư với H2SO4 loãng.
Theo ĐLBT mol e, có: 2y = 0,1.2 ⇒ y = 0,1 (mol) (1)
_ Khi pư với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Theo ĐLBT mol e, có: 2x + 3y = 0,2.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,05\left(mol\right)\\y=0,1\left(mol\right)\end{matrix}\right.\)
⇒ m = mCu + mFe = 0,05.64 + 0,1.56 = 8,8 (g)
Bạn tham khảo nhé!